免疫疗法黑科技!纳米抗体+声控细菌可有效对抗肿瘤
免疫疗法以其特异性攻击癌细胞、副作用显著小于化疗手段等优点,正在迅速成为一种新兴、有希望的癌症治疗技术,尤其是在治疗血液瘤方面,免疫疗法表现十分出色,然而,实体瘤的应用中却大不如前者,主要是因为在肿瘤免疫抑制环境中,抗体在靶细胞中的穿透性和功能降低,特别是在免疫豁免区的低氧肿瘤核心。
近年来,合成生物学的快速发展推动了基因工程微生物的发展,后者正在作为包括癌症在内的多种疾病的治疗剂。特别是针对实体瘤的免疫抑制微环境为全身给药的细菌植入和释放治疗有效载荷创造了有利的环境。
细菌做载体,将治疗性抗体递送至难以到达的肿瘤细胞中,是近些年新兴的一种“溶瘤细菌免疫疗法”,最先由Tal Danino教授等人在2016年提出,相关概念验证研究的结果还发表在了当年的Nature期刊上。
在最新的一项研究中,来自加州理工学院的科学家们在溶瘤细菌免疫疗法的基础上进行了一项创新性改造——在工程菌株中插入可产生治疗性蛋白的纳米抗体基因和可触发超声波脉冲的“热开关”基因,一旦细菌到达目的地,就可以通过超声波脉冲触发它们产生抗癌药物。

DOI:https://doi.org/10.1038/s41467-022-29065-2
“这项技术的目标就是利用工程菌浸润肿瘤的能力,同时利用超声波激活它们在肿瘤内释放强效药物”通讯作者Mikhail G. Shapiro解释说。
研究人员首先确认了一种名为 Nissle 1917 的大肠杆菌菌株,该菌株已被批准用于人类医疗用途。在注入血液后,这些细菌会扩散到全身并被患者的免疫系统破坏——除了那些已经定植癌肿瘤的细菌外。
为了将细菌变成治疗癌症的有用工具,研究小组对它们进行了改造,使其包含两组新基因。一组基因用于产生纳米抗体,这是一种治疗性蛋白,可以关闭肿瘤用来防止免疫系统产生抗肿瘤反应的信号,使免疫系统恢复正常的杀伤肿瘤细胞的功能。另一组基因就像一个热开关,当细菌达到特定温度时打开纳米抗体基因。
通过插入温度依赖性和纳米抗体基因,该团队能够创造出只有在加热到 42-43 摄氏度的触发温度时才会产生抑制肿瘤的纳米抗体的细菌菌株。由于正常人体温度为 37 摄氏度,因此这些菌株在注射到人体时不会开始产生抗肿瘤纳米抗体。相反,它们在肿瘤内部悄悄地生长,直到外部源将它们加热到触发温度。
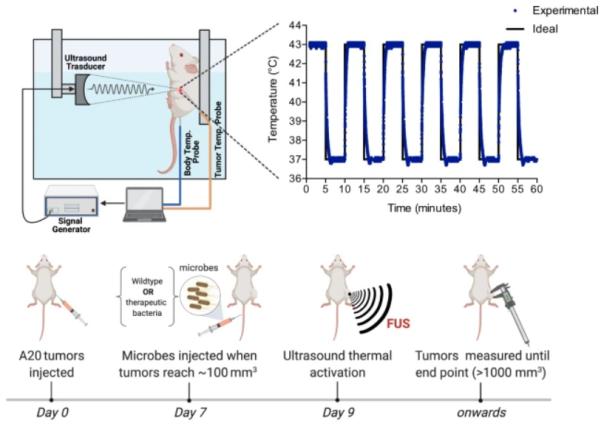
在特定肿瘤部位使用FUS可以激活小鼠体内的工程菌株释放抗癌纳米抗体
为了特异性加热位于肿瘤生长的身体深处的特定细菌,该团队使用了一种名为聚焦超声 (FUS)的技术,FUS 是一种高强度的聚焦超声,可密集聚焦在一个特定的点,导致该位置的组织变热,同时不会使周围的组织变热;通过控制超声波的强度,研究人员能够将组织的温度提高到特定程度。
如果仅将免疫治疗剂和细菌制剂结合可能会导致细菌制剂在除肿瘤外的其他器官中引起严重副作用,根据共同领导该项目的Mohamad Abedi博士解释,聚焦超声能够特异性激活肿瘤内靶组织并起到靶向杀伤治疗效果。
为了测试他们的工程细菌菌株是否按预期工作,研究小组将细菌细胞注射到肿瘤小鼠模型中。在让细菌在一定时间内渗入肿瘤后,研究小组使用超声波对其进行加热。
通过一系列试验,研究人员发现,用这种细菌和FUS治疗的小鼠比只用FUS治疗的小鼠、只用细菌治疗的小鼠和根本没有用细菌治疗的小鼠表现出的肿瘤生长要慢得多,其中六个经FUS激活处理的肿瘤有一个在治疗后完全消失。此外,这些工程菌只会集中在肿瘤区,小鼠的肝脏和脾脏样本检测到工程菌的数量都很低,证明这种疗法只靶向肿瘤,不影响其他组织。
Shapiro认为,这是一个非常有希望的结果,“因为它表明我们可以在适当的时间为肿瘤提供靶向治疗。”据悉,团队将继续优化这项技术,包括在超声波前对工程菌进行可视化,保证激活的有效性,继而更精准地进行靶向治疗。
参考资料:
1.Ultrasound-controllable engineered bacteria for cancer immunotherapy
2.Fighting cancer with sound-controlled bacteria

