Nanobody vs ScFv
随着重组DNA技术的出现,许多抗体片段已经被开发出来。其中,骆驼重链可变区(VHHs)和单链可变区(ScFv)是最受青睐的可变区。在单链抗体被广泛应用的同时,骆驼纳米抗体(nanobodies)由于具有更高的溶解度、稳定性、更小的尺寸和更低的生产成本等优异的化学和物理特性,正在作为一种替代品被广泛研究。本文就两者的结构,理化性质做一些比较。
纳米抗体和scFv 的结构
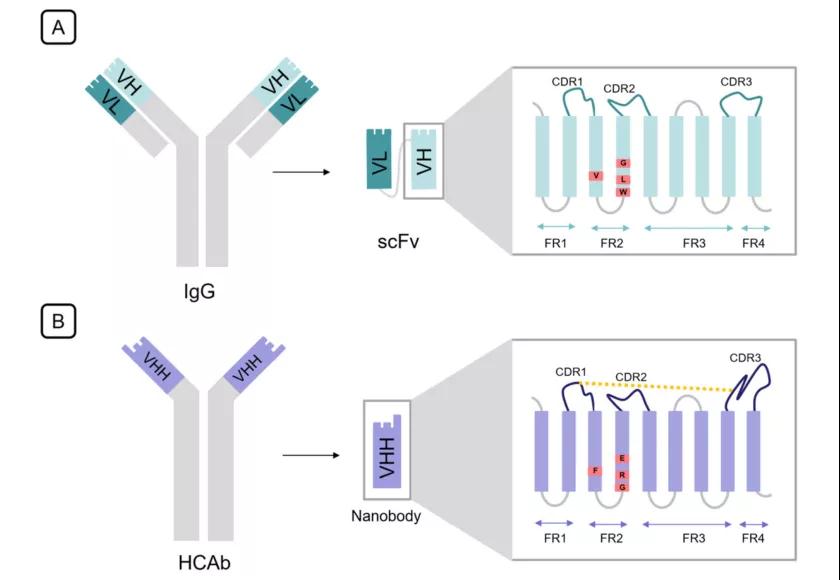
图1. 纳米抗体和scFv 的结构比较
VH在抗原结合中的较高贡献提出了一个假设,即单个重链是否可以保留亲本Ab的结合亲和力。经过一些研究,发现它们的一些不佳的特性,例如低亲和力,溶解度差和更高的生产成本,这阻碍了它们的发展。
在骆驼中发现了仅有重链的抗体(HCAbs),在软骨鱼中发现了免疫球蛋白新抗原受体(IgNAR),这是纳米抗体发展的一个新起点。这些特异性免疫球蛋白的抗原结合域(VHH和V-NAR)是一个高亲和力的V型结构域,它已经进化到没有以往常规单个重链片段的缺点。这些优异的性能源于序列和结构上的重大调整。由于骆驼纳米抗体比鲨鱼 V-NAR 更容易处理、更强大的抗体应答反应和更高的重组表达产量,因此 VHH 片段被更频繁地使用。
与VH相似,骆驼VHH由9个β带组成一个典型的IgV折叠,但VL缺失导致这两个片段之间存在显著差异,特别是在FR2和高变环中。在传统的VH区,FR2由四个高度保守的疏水氨基酸组成(Val37、Gly44、Leu45和Trp47),它们与Gln39、Gly44、Tyr91和Trp103一起形成一个保守的疏水界面,以促进VL的连接。在纳米抗体中没有VL的情况下,这四个疏水残基被更亲水的氨基酸(Phe37,Glu44,Arg45和Gly47)取代,以避免如此大的疏水区域暴露在溶剂中。除了这种取代外,该界面附近的残基还旋转了它们的侧链,而不变形C-α backbone,从而增加了VHH表面的亲水性。此外,VHH的CDR3结构域折叠在这个界面上,以保护以前被VL覆盖的氨基酸。这些变化阐明了VHHs的溶解度比ScFv和常规的单个重链VH要高。
在VHH中,高变量区的loops的扩展弥补了3个VL CDR和VH-VL组合多样性的损失。CDR1和CDR3的延伸提供了由来自VH-VL结构域的六个环提供的600-800A2抗原相互作用表面。此外,在VHH胚系中印有突变热点的延长的CDR1弥补了VL伙伴的变异性。虽然延长的CDR3可以延伸到常规抗体几乎无法接触到的表位,但扩大的loop意味着更大的灵活性,阻碍了抗原的熵结合。为了解决这个问题,VHH进化出了一个朝向CDR1、CDR2或FR2的额外的二硫键。所有这些结构特征增加了表位的多样性,并允许各种各样的几何环状结构,这些结构从根本上偏离了常规抗体定义的规范环状结构,并有助于CDR3朝向抗原的方向。
纳米抗体与ScFv的物化性质
由于结构上的显著差异,ScFv和纳米抗体在体内外表现出不同的性质 (图2)。
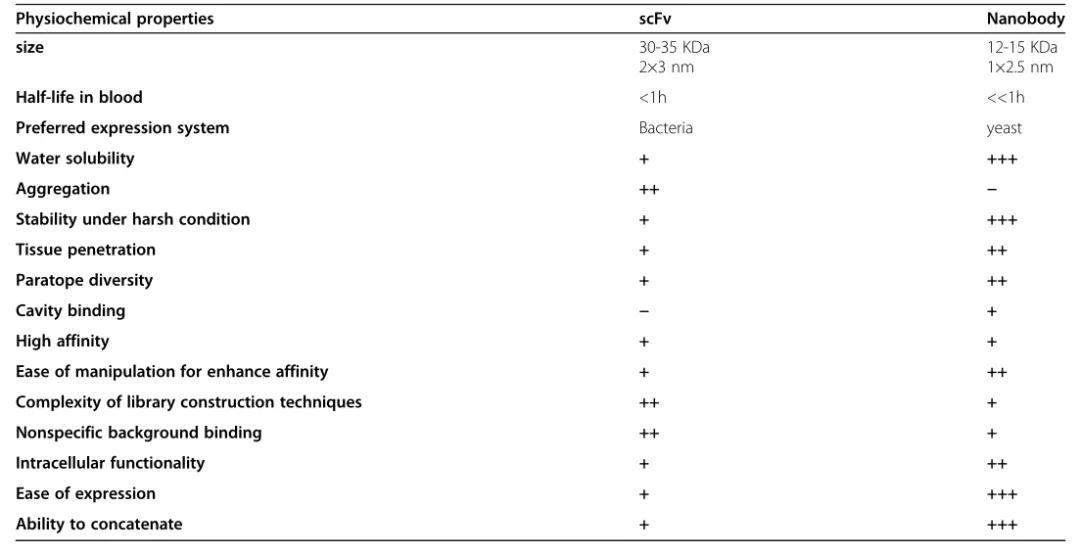
图2. ScFv和纳米抗体在体内外表现出的性质
Size(大小)
首先也是最重要的是,这两个片段在大小上有显著的不同,ScFv的大小几乎是纳米抗体的两倍,重量约为30 kDa。较小的尺寸有利于VHH的基因操作,并且只有三个抗原结合环的存在可以很容易地增强其固有的抗原倾向。由于肾脏的过滤和降解,VHH的尺寸较小也导致它们在血液中的半衰期较短。这一特征可能有帮助,因为它导致组织高通透性,但不利的是,因为它们的分子量低于肾小球滤过截止大小(65 KDa),可能在一些需要长时间抗体循环的临床治疗中出现问题。这一限制导致了将VHH与额外分子相结合的半衰期延长策略的发展。其中最流行的一种是添加稳定基团,如聚乙二醇(PEG)分子,这种分子可以减缓血液清除率。与长循环血清蛋白如白蛋白或白蛋白的特异性结合物融合,可有效地增加VHH在血液中的半衰期。Fc融合可以稳定它们在血液中,同时刺激免疫系统到达靶部位。此外,Fc或白蛋白融合使抗体片段更大,并实现FcRn介导的循环,以增加在血液中的半衰期。
溶解度和稳定性
如前所述,在VHH,四个高度保守的疏水氨基酸被更多的亲水残基取代,导致了纳米抗体和ScFv之间性质的显著差异。在ScFv中,FR2中的这四个残基(V37、G44、L45和W47)形成疏水界面,促进VH-VL连接。然而,不利的一面是,这个疏水区降低了ScFv的溶解度,导致它们有很高的聚集倾向。极性和较小的氨基酸残基在这个位置(F37或Y37, E44, R45和G47)的取代使它们更亲水,因此比ScFv更容易溶解。此外,与ScFv相比,这种非极性到极性的转变导致了VHH的分子和热力学稳定性。因此,纳米抗体更耐化学变性剂和蛋白酶,在苛刻的pH或离子强度下具有更高的稳定性。这种更高的构象稳定性还源于额外二硫键的存在,这降低了热诱导聚集的可能性,并限制了VHHs的灵活性。由于更高的稳定性,它们显示出高的重折叠效率,这意味着升高或降低样品温度不影响纳米抗体构象,与靶标脱离和结合,不会发生任何聚集或变性。这种结构上的刚性是临床上最喜欢的属性,因为非天然蛋白聚集是抗体治疗的常见缺点,在严重情况下会增加免疫反应。
免疫原性
单链抗体的一个重大缺点是它们大部分来源于啮齿动物,因为杂交瘤技术只在小鼠和大鼠身上得到很好的发展。小鼠VL和VH与人类相应区域的序列同源性分别只有53%和51%,而纳米抗体与人类VH(VH3基因家族)显示出很高的序列相似性,约75-90%的同源性与临床应用中免疫原性较低有关。因此,VHH的人性化程度更高。即使在鼠源scFv人源化之后,scFv的可变区仍能引起抗独特型反应。此外,scFv工程化降低人抗鼠抗体(HAMA)的反应可能使注射的scFv失活并降低其临床有效性,并且在重复给药时会出现过敏反应。此外,人源化降低了这些片段的结合亲和力,CDR嫁接可能代表新的免疫原性表位。总的来说,鼠源性单链抗体的人源化可以在一定程度上克服这些免疫原性问题,但不能完全克服。
亲和力
虽然ScFv和纳米抗体具有相似的亲和力,但它们对表位表现出明显的偏好。纳米抗体更容易接触到离子通道、病毒糖蛋白或免疫突触等抗原表面的凹槽和裂隙,但ScFv更喜欢平坦的线性表位。这些差异是由于纳米抗体中较长的CDR3环,允许高度凸起的形状来访问凹形表位。纳米抗体还表现出对平面表位的良好亲和力,这表明这些片段可以形成各种界面复合物。此外,与ScFv相比,纳米抗体的非特异性背景结合更低。
重组DNA技术的出现使得各种抗体片段的设计和构建成为可能。目前纳米抗体和单链抗体(ScFv)这两个片段是应用最广泛的抗体片段。通过比较了这些片段的结构和性质,以研究哪些抗原结合结构域对于某种应用是优选的。总体来看,纳米抗体由于较高的稳定性,溶解性和较低的生产成本使其在几乎所有应用中都是有利的,但其较小的尺寸则是一把双刃剑。尽管纳米抗体具有优越的特性,但目前单链抗体仍然在临床上占据主导地位。纳米抗体要成为重组抗体市场的主导者,仍有很长的路要走。
参考文献
1.A comprehensive comparison between camelid nanobodies and single chain variable fragments.
2.Nanobody Engineering: toward next generation immunotherapies and Immunoimaging of cancer.

