研发空间巨大,成药潜力可期!——GPCR“联姻”纳米抗体
1. GPCR功能、结构和分类
GPCR(G-protein coupled receptor,G-蛋白偶联受体)是一类在人和动物中,广泛存在于细胞膜上的最大膜蛋白家族。细胞膜上的GPCR与细胞外的内源配体结合后被激活,通过(一)与细胞内G-蛋白结合,激活G-蛋白,诱导生成第二信使(cAMP,IP3/DAG)及G-蛋白亚基,激活下游信号传导通路;(二)同时或随后结合beta-arrestin,诱导beta-arrestin介导的下游信号通路,实现传导细胞外生理信号到细胞内,对细胞、组织及器官进行代谢、生理功能的调节。
所有GPCR蛋白均是由一条氨基酸单链所构成。如图1所示,GPCR氨基酸链从细胞外的N-端(N-terminus)开始,穿过细胞膜双脂层,再回穿过细胞膜,如此往返7次,形成7个跨膜域(7 transmembrane domains,7TM),3个膜外环链(extracellular loop,EL)和3个膜内环链(intracellular loop, IL),C-端(C- terminus)在细胞内。7TM在细胞膜中形成桶状结构,其氨基酸序列在同一类型GPCR中相似度高,GPCR其它区域氨基酸序列则具备不同程度的特异性。GPCR蛋白在被合成转运至细胞膜上的过程中,被进行多种翻译后修饰(post-translationalmodification),如糖基化(glycosylation);与激动剂结合被激活,构象(conformation structure)会发生相应改变,并被被进一步修饰,如磷酸化(phosphorylation)。GPCR氨基酸序列和被修饰的特异性,决定每一GPCR的可能构象结构、与配体、G-蛋白、beta-arrestin结合和信号传导的特异性。
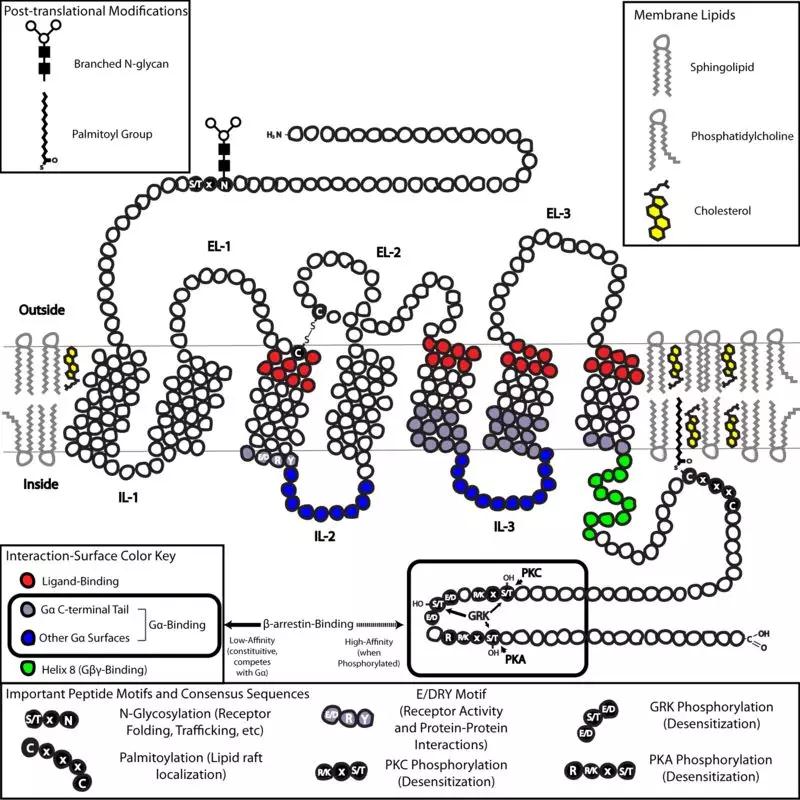
图1. GPCR在细胞膜上的结构、主要氨基酸模序、修饰及蛋白结合位点示意图
GPCR按氨基酸序列相似性可以分为7个家族,人GPCR蛋白目前按系统发生分析方法(phylogenetic analyses)可以分为5类(GRAFS)。图2显示了5个GPCR家族(A, B, C, D, E)在细胞膜上的结构示意图。A、B、C家族分别对应人GPCR的R(Rhodopsin-likefamily),SA(Secretin &Adhesion family)和 GT (Metabotropic Glutamate, Taste 1 family)类。D为真菌交配弗洛蒙受体家族(Fungal mating pheromone receptors),E为盘基网柄菌cAMP受体(Dictyostelium discoideum, cAMP receptors)。不同家族的GPCR蛋白有以下几处显著差异:(1)N-端氨基酸链的长度和序列;(2)配体与GPCR结合的位点(注:a.结合位点与各类受体可结合的配体类别和大小相关;b. A家族受体数量最大,图2显示的膜内结合位点仅代表部分与小分子配体结合的GPCR,不反映A家族的多肽和蛋白类GPCR的配体结合位点);(3)C-端氨基酸链的长度。图2中显示同一家族GPCR在跨膜和近膜结构中具有不同数量的保守氨基酸,及N-端和近膜端保守的可被棕榈化和形成二硫键的半胱氨酸(cysteine)。这些氨基酸在维持GPCR在细胞膜上的结构、构象及与配体特异结合上,发挥着重要作用。
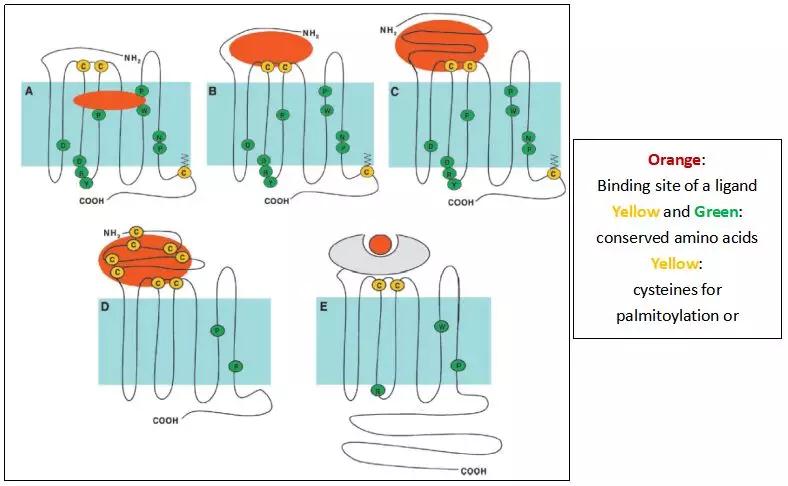
图2. GPCR家族分类、结构及其氨基酸序列、配体结合位点的异同处
2. 以GPCR为靶点的药物研发
人体内共有约800种GPCR表达,其中~400种为嗅觉受体(olfactory receptors),其余398种GPCR为非嗅觉受体。A家族GPCR种类最多,有约670种GPCR,占所有GPCR总数的80%。B家族GPCR其次,有约50种GPCR。当前,所有已上市或在研的GPCR药物靶点均属非嗅觉GPCR。据2017年7月统计报道,目前世界上共有475个药物以GPCR为靶点,占所有FDA批准药物的34%左右,其中314个药物作用于A家族GPCR中的氨类受体(aminergic receptor),以小分子为主。在398种非嗅觉GPCR中,已批准的靶向GPCR的药物仅作用于其中的108种GPCR;66种无上市药物的GPCR处于临床研究阶段,其中37种GPCR的内源配体为多肽或蛋白;多达224种GPCR还没有成为任何进入临床试验的药物靶点。
GPCR内源性配体具极大多样性,包括离子,信号小分子,脂类,多肽和蛋白。靶向GPCR的药物通常依据特定GPCR的内源性配体进行理化性质设计和开发,与内源性配体具一定相类性。目前上市的靶向GPCR药物绝大多数为小分子。多肽类靶向GPCR药物数量较少,但如GLP-1(glucagon-likepeptide-1)类似物(exenatide, liraglutide, lixisenatide, albiglutide,dualglutide,semaglutide),作为GLP-1R激动剂,在治疗2型糖尿病中,展示了显著效果,占有大量市场份额。
那么,靶向GPCR的蛋白类药物开发状况到底如何呢?
当前只有2个GPCR单克隆抗体(mAb)药物获批上市 (CCR4 mAb, mogamulizumab,治疗淋巴瘤lymphoma;CGRPRmAb,Erenumab,治疗偏头痛migraine)。有近40个靶向少数几种GPCR的mAb处于临床前或临床药物研发阶段。靶向GPCR膜外区域的纳米抗体药物研究(下节介绍)则仅处于早期的临床前和实验室研究阶段。按配体性质分析GPCR家族,可以发现,在非嗅觉GPCR中,有130种GPCR是多肽和蛋白类受体。这些GPCR均可作为潜在、成药性高的蛋白特别是抗体药物靶点。理论上,其它任何GPCR均可能成为蛋白类药物靶点。因而,开发靶向GPCR的蛋白类药物空间巨大。
3. 纳米抗体(nanobody)在GPCR研究和药物开发中的应用
3.1 纳米抗体(nanobody,Nb)
如图3所示,常规抗体(antibody, Ab)由2条重链(含CH1-3和VH区)和2条轻链(含CL和VL区)组成。而骆驼科动物(如羊驼)由于一系列生殖细胞基因突变和删除,血液中表达一种独特的天然缺失轻链的单链抗体,该抗体只包含一个重链可变区(VHH)和两个常规的CH2与CH3区,被称为重链唯一抗体(HcAbs,heavy chain only-antibodies)。其在免疫系统中仍然能够进行亲和力和选择性成熟改变,从而在两个相等的单个可变区内聚集所有的抗原结合能力。依据骆驼科动物重链可变区(VHH)的结构可以通过生物工程技术衍化生成特异单域抗体(sdAb, single domain Abs)。因VHH抗体结晶为直径2.5nm,长4nm,分子量只有15KDa, 因此对应的sdAb,或VHH抗体被称为为纳米抗体(Nanobody©,Nb)(图3)。软骨科鱼(如鲨鱼)也被发现表达HcAbs,其重链可变区(VH)及对应的sdAb被称为VNAR(variable new antigen receptor)。
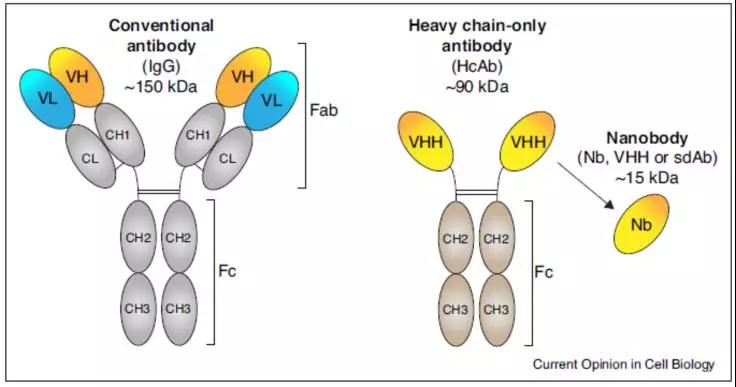
图3. 常规抗体(IgG)和骆驼科动物体内重链单一抗体(HcAb)的组成结构及其衍生的特异抗体。
3.2 纳米抗体的优势
相对于传统抗体,纳米抗体体积小,分子量(~15 KDa)只有传统抗体的十分之一,是目前已知的可结合目标抗原的最小单位。可穿透血脑屏障,对人的免疫原性弱。相比体积也小的抗体衍生片段(分子量为传统抗体的1/3-1/6),如Fab片段,单链抗体片段(scFv,single-chain variable fragments),纳米抗体没有这些片段容易相互沾粘,甚至聚集成块的缺点。更重要的是纳米抗体保持了与原重链抗体相当的高结构稳定性、溶解性以及与抗原的结合活性。纳米抗体的另外一个重要优势是可以在细菌和酵母中高产量生产。
比较纳米抗体和Fab结合位点,及与GPCR的结合部位,如图4所示,纳米抗体具有较传统抗体长的CDR3 (complementarity determining region,互补决定区),可以形成更为凸起的抗体结合部位(paratope),因而能够结合隐藏的GPCR免疫表位(epitope)。这些特性使得设计出结合GPCR精细、隐蔽位点的特异纳米抗体成为可能。
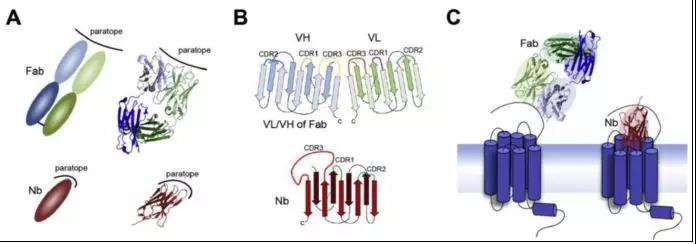
图4. 抗体结合部位(paratope)及Fab片段和纳米抗体(nanobody)与GPCR的结合。
A) Fab片段有一较大的凹型抗体结合部位,相对应,纳米抗体抗体结合部位小而凸。B) Fab片段VH/VL区和VHH区/纳米抗体结构示意图。C) Fab片段的结合位点形状适宜结合线性免疫表位(如GPCR的N-端, N-terminus),而纳米抗体能够结合结合隐藏的免疫表面,如GPCR的配体结合口袋(binding pockets)。
3.3 纳米抗体作为GPCR构象稳定器
GPCR在细胞膜上始终处于一个动态过程,可以多种构象存在。GPCR激动剂(agonist),拮抗剂(antagonist)或反向激动剂(inverse agonist)与GPCR结合并诱导不同的构象变化。获得并分析GPCR的晶体结构对于研究GPCR与配体结合时的结合位点和构象、功能和调节及药物设计非常重要。目前,多数GPCR晶体结构是在小分子拮抗剂结合状态下获得的非激活构象。对于小分子激动剂结合状态下的GPCR激活构象,因其呈现为非均质相,则难以获得具高分辨率的晶体结构。利用纳米抗体的体积微小、具高特异、高亲和力的特点,科学家使用纳米抗体克隆Nb80结合β2AR膜内结合区,稳定β2AR与激动剂BI-167107结合,成功解析出激活状态下的β2AR晶体结构。
纳米抗体还作为G-蛋白类似物,被用来稳定GPCR(M2R, μ-OR, κ-OR,US28)的活性构象,获得晶体并被解析结构。研究人员还将纳米抗体与GPCR (β2AR, M2R or μ-OR) C-端链接,锁定受体活性构象,进行基于片段的筛选(fragment-based screen),筛选出偏好结合受体活性结构的片段。
3.4 纳米抗体调节GPCR功能
纳米抗体按其与GPCR在细胞上的结合部位划分为两类:细胞膜外纳米抗体(extracellular nanobody)和细胞膜内纳米抗体(intracellular nanobody,intrabody)。
(1)细胞膜外纳米抗体(extracellular nanobody)
纳米抗体因其结构简单,可以开发成多种形式,如单价Nb(monovalent,1 Nb结合1个免疫表位),双价Nb(bivalent,2 个链接的Nb结合到同一免疫表位),双特异性Nb(bispecific,2个链接的Nb链接结合到不同靶点), 双抗体结合位点Nb(biparatopic,2个链接的Nb结合同一靶点上的2个免疫位点),及3价Nb(trivalent,链接3个Nb)等。不同结构的纳米抗体能够增加Nb亲和力和效能,获得不同的药理学作用。表1列出了靶向CXCR2,CXCR4,ACKR3 (CXCR7), US28和mGluR的不同形态的膜外纳米抗体克隆及相应的药理学活性。这些膜外纳米抗体与GPCR结合,能够展示出拮抗剂(antagonist)作用,反向激动剂(inverse agonist)作用,反向或正向别构调节剂(NAM, negative allosteric modulatotor;PAM,positive allosteric modulator)作用。需要提出的是,目前难以获得具有激动作用的单克隆抗体,纳米抗体也是一样。当然,通过基因工程技术,直接链接自然肽类激动剂或其类似物到抗体,有可能获得作为激动剂的靶向GPCR抗体。
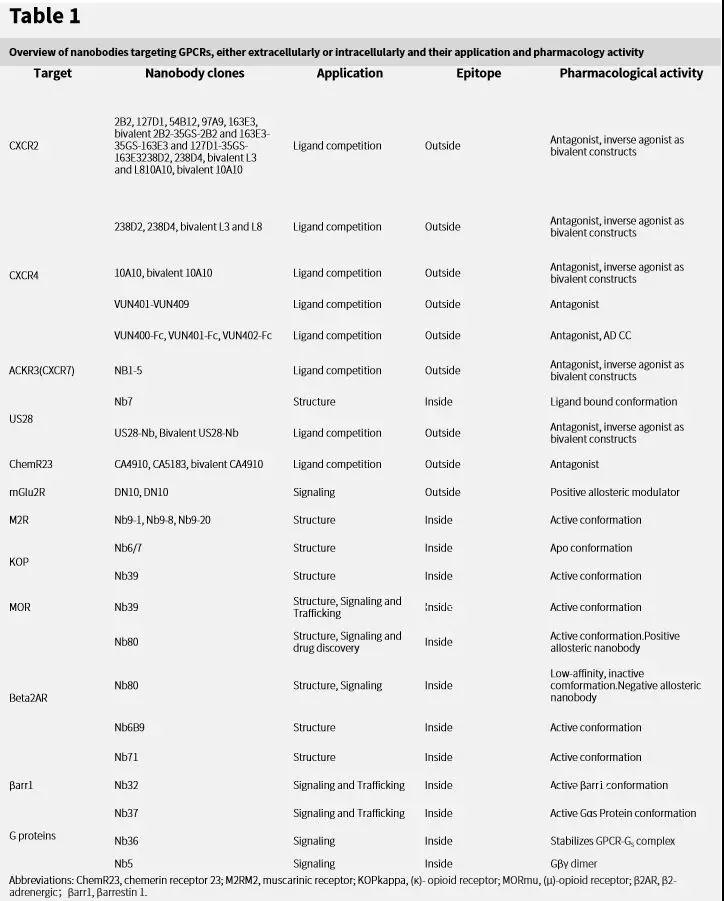
表1.细胞外或细胞内靶向GPCR的纳米抗体、应用和药理活性概况
(2)细胞膜内纳米抗体(intracellular nanobody,intrabody)

