Rosenberg居然用猪淋巴细胞治疗过肿瘤?CAR-T发展史精彩程度超过您的想象
时间回到1968年,那时的Steven Rosenberg 还是名住院医师,在一日例常的工作中遇到了一名极为罕见的病例。病人右上腹部疼痛难忍,Rosenberg经过检查后认为患者是急性胆囊炎,进行胆囊切除术就可以了。
但在手术台上,他发现患者的腹部有一道巨大的手术疤痕,Rosenberg在术后问患者是否接触过大型手术,但出乎意料的答案是“做过,很多年前因为癌症做过手术”。
当年轻的Rosenberg调出这个病人的档案后,他不淡定了,因为这个手术发生在1956年。这名患者因为患有消化道肿瘤而在这家医院接受过手术。很明显,这名患者是名晚期患者,因为12年前的手术记录中写着,主刀医生虽然可以将一些大的肿瘤切除,但对小的转移灶无能为力。医生也许出于临终关怀,在术后建议病人出院回家,让家人陪伴他度过最后的时光。
最让Rosenberg惊讶的故事出现了,患者在术后3个月来到这家医院复诊,并且在一年后,这位病人居然回到了工作岗位!当时的 Rosenberg觉得这种情况只有两种解释。一是医生诊断错误,患者根本没有得肿瘤,这根本就是一场医疗事故(还好不是在中国),虽然存在这种可能性,但是概率并不高。而第二种可能是病人的癌症经历了自发缓解过程而痊愈了。但这种情况发生的概率更低,因为直到Rosenberg遇到这位病人之前,医学文献中仅仅报道过四位这样类型的患者。
Rosenberg调取了这名患者所有的原始病理报告和组织切片,并再次确认了患者当年的确患有肿瘤。 唯一的解释就是患者自愈了,这对于年轻的Rosenberg而言简直难以置信,脑洞大开的Rosenberg认为患者的血液中可能存在某种可以抵抗肿瘤的因子,为了验证自己的设想,他在医院中找到一位和自愈患者血型一致、肿瘤类型相同的患者,在获得这名患者的同意后,Rosenberg将自愈患者的外周血输入到这名患者的体内。
很不幸,Rosenberg所期望的奇迹没有发生,新患者的疾病进展迅速并撒手人寰。但正如所有成功者一样,这次的失败并没有让Rosenberg失去热情,反而激起他对肿瘤和免疫学的激情,并转入哈佛进行了系统的学习,并一发不可收。
Rosenberg一直都是一个不折不扣的工作狂。在他还年轻的时候,他甚至想过跟当时还是女朋友的Alice O’Connell分手,因为他觉得恋爱会分散他进行科研的精力。“我很喜欢夜晚,”Rosenberg在1992年出版的一本书The Transformed Cell中这样写道。他还能回忆起年轻时深夜在实验室工作的喜悦,喝着在加热器上已经热了几个小时的早已煮的粘稠的咖啡,迎着早晨的太阳走出实验室,大概这世上再找不到能与之媲美的满足感了吧。
要有光
当Rosenberg刚踏入NCI大门的时候,人们对免疫系统抗肿瘤的机制了解甚少。甚至在1970年代,仍然有很多人不相信人体内的免疫系统可以对抗肿瘤,但Rosenberg坚信免疫细胞的潜力,甚至做过许多匪夷所思的临研,比如当时有研究表明,将某些肿瘤抗原输注猪和兔子体内可以引发动物的免疫反应。Rosenberg当时认为这也是动物体内的某些因子的作用,于是脑洞大开的Rosenberg将猪的淋巴细胞输注病人体内。毫不意外,这些临床实验都没有成功。
正在无数人为之探索之际,Robert Gallo实验室在1976年发现白介-2可以在体外刺激T细胞的增殖。Rosenberg希望能将这项发现应用到肿瘤的治疗中,希望通过体外扩增T细胞后回输到病人体内。当时Rosenberg已经意识到T细胞在抗肿瘤中的作用,他认为在外周血中总是有一群T细胞对肿瘤细胞有特定杀伤能力,如果将这些细胞进行大规模扩增的话,就一定有希望实现体内的肿瘤杀伤效果。(当然,Rosenberg没有想到,在30年后遥远的东方,有那么一群人将这个技术玩坏了。。。。。。。)。
但让Rosenberg郁闷的是,无论是将IL-2培养过的T细胞还是直接回输IL-2,都没有获得他想要的疗效。更窝心的是,IL-2的毒性大出乎意料,几乎可以将每位接受治疗的病人送进ICU。至1984年,Rosenberg试过了太多的方案,据说参与他临床实验的66名患者无一成功,直至1984年,他遇到了自己的第67名患者Linda Taylor,一位患有黑色素瘤的海军军官。Taylor是Rosenberg第一位接受同时接受T细胞和IL-2输注的患者,也是第一名被Rosenberg成功治愈的并存活至今患者。随着其他患者的成功治疗,Rosenberg以及IL-2疗法终于登上头条,而他NCI的一些同事也开始称呼他为Stevie Wonder,这或许是免疫治疗史上的第一缕光吧。
但随着研究的深入,人们郁闷的发现这种疗法也不算太靠谱,只有很少部分的和素瘤和肾癌患者受益。此时的Rosenberg开始尝试从肿瘤提取侵润的淋巴细胞(TIL),并经体外扩增后联合IL-2治疗患者。于是,这又引出了下一个故事,怎样让TIL活的长一点。
再久一点
事实上,这个时候的Rosenberg的研究越发的靠谱起来,就如同所有的PI一样,Rosenberg的研发方向有开始有了分支,其中一项就是如何延长TIL在细胞内的存活时间,于是乎,这个任务就落在了1989加入Rosenberg实验室Patrick Hwu的身上。
当时HWU为了标记回输病人体内的T细胞,将新霉素磷酸转移酶编码基因插入T细胞的基因组中。由于这个基因是新霉素的抗性基因,因此重组T细胞回输体内几周后,采集患者外周血PBMC样本,通过新霉素的筛选后,可以检测到存活T细胞的数量。
但同样让Hwu意外的是,这些回输的TIL细胞在人体内的存活时间只能维持3周左右的时间,但人体内的一些T细胞可以存活长达数年时间,这或许是TIL疗效不佳的原因之一。为解决这个问题,Hwu采用了后来CAR-T临床实验中常见的手段:清髓化疗。其实这一灵感来自于骨髓移植,在骨髓移植前进行的氟达拉滨/环磷酰胺清髓方案,在摧毁病人免疫系统后,可以为后植入的免疫系统提供足够的生存空间。
后来证明这个方案有一定的有效性,但用于黑色素瘤以外的肿瘤治疗中,效果依然很差。为解决疗效的问题,Hwu对TIL进行了一系列的改造,例如将TNF基因导入TIL中,期望这些细胞在迁移至肿瘤所在位置后,分泌TNF。但是这些研究进展十分的缓慢,事实上直到今天TIL细胞的培养都是一个技术难题,而且当时对TIL细胞转染的技术手段也极为有限,所在经过多年的努力后,Hwu的项目始终没有获得成功。
但是将外源基因导入T细胞经验却对故事中的另一个主人公的研究带来了巨大的影响,创世纪的光芒终于在大地上催发了一颗种子。
发芽!发芽!
Zelig Eshhar博士,出生于以色列一个名不见经传的小镇,从博士起就专注于免疫学的研究,也是在某一天,Zelig Eshhar突然脑洞大开,一种新的细胞受体结构出现了。Zelig在研究TCR结构时,认为TCR的结构和抗体结构太相似了。从结构上讲,TCR由alfa和beta链组成,抗体由重链以及轻链组成,两者都包含恒定区以及可变区。而从功能上讲,TCR以及抗体都有抗原识别的功能。而且表达抗体和TCR的基因属于同一个基因家族,但两者在识别抗原的方式上有很大的不同。
抗体可以识别抗原的固有形态,但TCR只能识别MHC递呈的抗原片段,如果将TCR可变区和抗体的可变区互换,会发生什么结果呢?后来Zelig的实验室将抗体的可变区移植到了TCR的恒定区,并证明了该嵌合抗原受体具有抗体类似的特性,并且可以结合靶抗原。当然如果将该技术用于肿瘤治疗领域的话,Eshhar仍有很多的技术问题需要突破,比如说之前实用的永生化细胞不能用于疾病的治疗,而且如何有效的将外源基因导入T细胞在当时也是一个技术难题。
为了解决这个问题,Eshhar最终和Hwu所在实验室合作,毕竟当时Hwu在T细胞基因编程领域积累的经验无人能比。两人最终使用单链抗体scFv和Fc受体来解决嵌合抗原构建了原始的CAR,并构建了三种分别靶向乳腺癌、结肠癌、卵巢癌的CAR,并将CAR过表达于TIL细胞表面,后来相关的一些数据成功于1993年发表,Zelig也并被顺利成章的认为是CAR-T领域的开山之作。但事实上,从事这项工作的人可不止 他们几个。就在Rosenberg实验室不远处的海军医院研究所里的Carl June也在做着同样的研究。

墙里开花墙外香
1971年,越南战争打得是有声有色,为扩大美军的兵员,每一名适龄男子都有可能会被征兵入伍,这让被后来中国人尊称为“卡六爷”的Carl June正陷入苦恼中,尽管已拿到斯坦福入学通知,但保不齐大学毕业后还是被送上越南战场接受“革命的考验”。后来June的选择证明了EQ和IQ具有相同的重要性。为了躲避后面的征兵,June主动加入了海军学院,要知道,陆战上无孔不入的北越军队,可是拿海军没有任何办法的。但由于海军支付了June本科和医学院学习的所有费用,所以他在海军服役后的时间被大大延长。事实上June从医学院毕业后,仍需为海军服务12年,在这些年中,骨髓移植是六爷的主要研究方向之一。
在这我们要普及一下,骨髓移植并不只是用于白血病的治疗,同样也是治疗重度核辐射损伤的唯一有效的办法,当时美帝海军安排June研发骨髓移植也是出于冷战中对核大战的顾虑。
故事拉回来,自从研究者意识到HLA配型在移植后的重要性后,骨髓移植疗法初见成效,但随后的移植物抗宿主病是几乎所有患者躲不掉的梦魇,但自从1983年环孢素用于移植物抗宿主病的治疗后,June对这类药的兴趣日渐浓厚,因为和其他的免疫抑制剂不同的是,这类药物只会抑制T细胞的功能,但对整个免疫系统不会有太大的干预。
但同时June发现,当环孢素和CD28单克隆抗体联合使用时,T细胞的抑制作用就会被消除,继而发现CD28可以以明显不同于CD3的信号通路活化T细胞。
随着柏林墙的倒塌和红色帝国的解体,核大战的恐惧就从海军的心头烟消云散,对骨髓移植治疗核辐射的研究经费也逐渐消减。这个时候June决定将实验室的研究转向HIV,希望使用细胞疗法治疗HIV感染。而在当时,已经有人尝试过体外扩增对HIV特异性的CD8+,并将这些细胞回输病人体内,希望可以清除HIV重建患者免疫系统。这种技术方案和Rosenberg实验室当年治理癌症患者的方案极为相似,但技术难度更困难,因为诱导激活CD4+T细胞时,也同样会活化HIV的复制,继而导致T细胞的死亡。
多年来对T细胞功能的研究,为June在HIV领域提供了巨大的帮助。由于对CD28功能的理解,他尝试实用CD28抗体激活T细胞上CD28受体,而在此过程中,他发现当使用游离的CD28抗体后,T细胞更容易被病毒侵染,而将抗体固定在培养皿底部时,T细胞却能抵挡HIV的感染。此时June希望通过对T细胞的受体进行改造,以提高CD8+T细胞对HIV感染细胞的特异性杀伤,而使用的技术也就是CAR-T。
事实上,很多人不了解是,世界上第一例的CAR-T临床实验实际上是用于治疗HIV感染的,June与Cell Gensys合作,构建了靶向CD4 zeta的一代CAR-T,在随后开展的三项HIV的临床实验中,证实了其临床使用中的安全性,并且证明的确有部分患者的免疫功能得到恢复,但June还没有来得急对CAR-T技术进行优化,Cell Genesys就于1997年停止了相关研究的资助,而且随着鸡尾酒疗法的上市,AIDS从某种意义上成为了一种慢性病,而CAR-T的竞争力也就不那么明显了。
但事实上,这几年CAR-T技术的研究,为后来的CAR-T的临床转化带来意想不到的发现:由于对T细胞的基因编辑可能导致潜在基因突变的风险,因此June在治疗HIV患者的临床实验中,对患者进行了长期的随访,并发现某些患者体内的CAR-T细胞可以存活数年甚至十数年之久,甚至部分患者体内CAR-T细胞的半衰期长达17年。

飞跃
但是这样的数据,对于Michel Sadelain来说非常难以置信, 因为Sadelain在九十年代初研究CAR T细胞的时候,他发现他使用的CAR-T细胞只能在肿瘤患者的体内存活不到一周的时间。
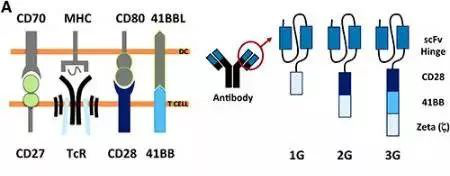
当时光返回倒上世纪八十年代,Sadelain还只是阿尔伯塔大学免疫学专业的一名研究生。他在SteveRosenberg的一次讲座中第一次听到了TIL这一可以治疗肿瘤的T细胞时,他感到万分的神奇。在完成博士学业后,Sadelain前往Whitehead Institute for Biomedical Research系统的学习了基因疗法相关的技术。到了1992年,Sadelain就已经能够成功对小鼠的T细胞进行改造。Sadelain在接触CAR-T时,当时觉得Zelig团队设计的第一代嵌合抗原受体虽然能够模拟天然TCR的功能来活化T细胞,但同时也存在着很大的缺陷。尽管第一代CAR-T的胞内段携带CD3 zeta,这足以使CAR有效地介导T细胞的杀伤作用,但问题是CAR-T细胞却无法有效扩增。同时CD3 zeta在多次抗原暴露后可维持起活化状态并继而引起凋亡,Sadelain推断这可能是第一代CAR-T疗法疗效不佳的一个很重要的原因。
而当Sadelain在系统的研究June曾经的工作后,大胆的将CD28插入到CAR的结构中之后,CAR-T的增殖问题就得到了很好的解决。于此同时,除了Sadelain,当时St. Jude 儿童研究医院的Dario Campana也在进行类似的研究,不过与Sadelain不同的是Campana使用的共刺激分子不是CD28,而是4-1BB。让他们没有想到的是,这两种设计成为了日后CAR-T产业化的关键。
花落谁家
如果不是1996年June的妻子被诊断患有卵巢癌,他可能会一直进行HIV的免疫治疗。但现在不同了,June尝试了各种免疫疗法来挽救妻子的生命,他坚信免疫治疗的效果,他在自己的实验室制备过GVAX疫苗,甚至尝试通过compassionate use来申请使用Medarex当时正在研发一款检查点抑制剂ipilimumab。但不幸的是Ipilimumab在2011年才上市,而Cynthia在2001年便离开了人世。丧妻之痛并没有动摇June对免疫治疗的信心,在爱妻离世之后,他加入了滨州大学,全身心的投入到免疫治疗的研究中,对CAR-T治疗肿瘤进行了更深入的研究。
此时的June深知自己设计得第一代CAR-T细胞的缺陷,当2003年June在一次学术会上了解到Campana构建得二代CAR后,随即从Campana处获得了相关得设计资料和载体;而同时,Rosenberg也从Sadelain处获得了基于CD28设计的CAR相关资料。
当时,CAR-T技术还没有像如今一样成为投资领域的宠儿,其临床价值还没有被更多的人认可。出于学术的目的,这些CAR-T研发的先驱者们,在CAR-T技术领域还有着密切的沟通,CAR-T技术也随之越发的成熟,但此时的研究面临着巨大的经费问题:无论是科学界还是制药公司,都没有对CAR-T技术表现出丝毫的兴趣:CAR-T技术个性化太强,批量化生产的成本让制药公司难以承受,而研究者发起的临床实验也没有发现更好了临床效果,学术界的经费申请几乎无法实现。此时,如果不是金主的出现,或许CAR-T技术早就湮灭于时间的流逝中。
正如一颗小石子的入水溅起了满湖的涟漪。2001年,与乳腺癌抗争了11年的Kimberly Netter因乳腺癌去世。其家人在2002年在听了一场基因疗法的学术报告后,成立了肿瘤基因疗法联盟(ACGT)以资助对肿瘤基因疗法的研究。也正式ACGT的资助,June的实验室得以继续运转,而到了2010年前后,CAR-T的主要研究团队已经准备就绪,各项临床实验也顺利开展,至此真正的CAR-T大战正式开始。

- 上一篇: 触发吞噬作用的嵌合抗原受体
- 下一篇: 这边的T细胞你清醒下,那边的肿瘤细胞你别装了