如何提高药物早期筛选效率?试试爱康得推出的全自动蛋白稳定性分析系统!
爱康得生物近期推出了蛋白稳定性分析平台,引进最新多功能分析仪NanoDSF,提供了一种简捷、快速分析蛋白质稳定性的方法。可同时测定48个样品,每个样品仅需10 μL;可测定蛋白热稳定性、化学稳定性、折叠自由能、胶体稳定性等。广泛应用于抗体等蛋白稳定性研究的各个方面,可用于制剂筛选、质量控制、长期储存稳定性研究等;还可用于膜蛋白detergent条件筛选等其他多个方面。
平台优势
01 同时且实时
首次实现在整个升温过程中实时监测和记录,同时提供构象稳定性、粒径及聚集数据,并在结构域水平上获得全面且完整的稳定性信息;
02 高特异性
可有效区分生物制剂信号与缓冲液或细胞间质信号;
03 数据精准,重复性好
误差范围极小,提供真实的检测结果;
04 通量灵活,操作简便
检测灵活,可同时测量48个样品,且样品消耗低
05 免标记
天然条件检测,可避免无需染料,消除缓冲液和去垢剂的干扰
应用领域
01 可开发性评估:可发行性评估的目的是在药物早期开发阶段表征影响样品稳定性、溶解度、聚集的理化特性,从而选择具有最小开发风险的候选物。
使用iCarTab蛋白稳定性分析平台:
> 确定聚集倾向
> 获得自身和非特异性相互作用
> 表征构象 (热) 稳定性
02 抗体工程/增强稳定性:我们可以通过抗体工程手段改造抗体分子、ScFv和Fab片段,使其具有更高的热动力学稳定性和更有效的折叠。为了确定哪些药物能够进入下一开发阶段,就需要选择一种能够灵敏发现稳定性微小差异的技术。
使用iCarTab蛋白稳定性分析平台:
> 确定聚集倾向
> 获得自身和非特异性相互作用
> 表征构象 (热) 稳定性
03 下游开发:在分离、纯化和放大的过程中,对候选分子进行监控,以确保这些过程不会对其稳定性造成负面影响。这就需要一种可以精确检测各项稳定性指标的技术。
使用iCarTab蛋白稳定性分析平台:
>表征构象(热)稳定性,并确定放大和优化过程中的聚集倾向和粒径分布
04 制剂研发:在预制剂研究中,初步确定候选分子的物理和化学性质。在制剂研究中,确认用于临床试验的最终处方,包括缓冲液和辅料的筛选以及兼容性。在这两个过程都需要评估稳定性属性,以帮助您选择最佳的配方。
使用iCarTab蛋白稳定性分析平台:
> 表征构象(热)稳定性
> 确定聚集的倾向
> 通过热变性、粒径大小,粒径分布和聚集倾向的检测,来完成缓冲液和辅料的筛选
05 新药审查 (IND) 和新药申请 (NDA):IND阶段,对于非临床毒理学研究中使用的研究产品,稳定性研究提供了杂质概况。在NDA阶段,稳定性被监控以建立适当的再测试或过期指导方针,长期储存条件,并提供各种环境条件影响的证据。
使用iCarTab蛋白稳定性分析平台:
> 测定初始和最终时间点的重组/稀释/混合的热稳定性和粒径大小
> 通过强制降解和光稳定性研究获得热稳定性和粒径大小
案例展示
爱康得可为您提供最全面的参数,同时且实时的检测更加高效,快速提供精准、可靠的结果
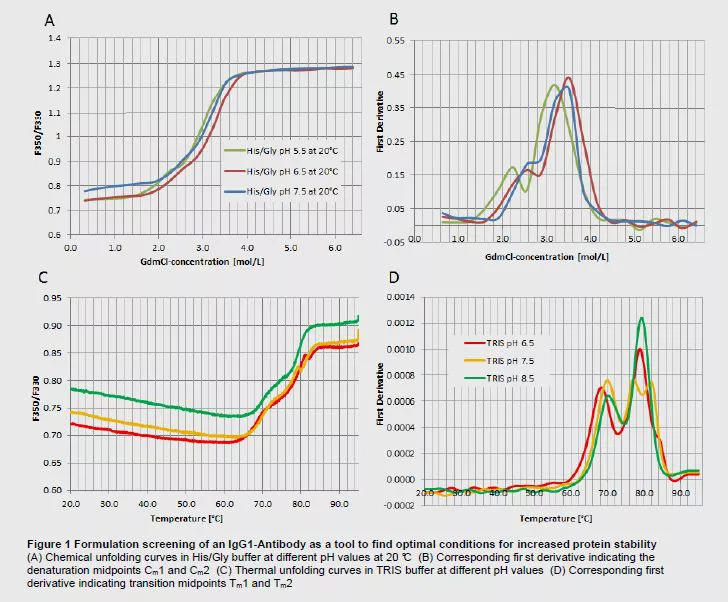
化学变性和热变性▲
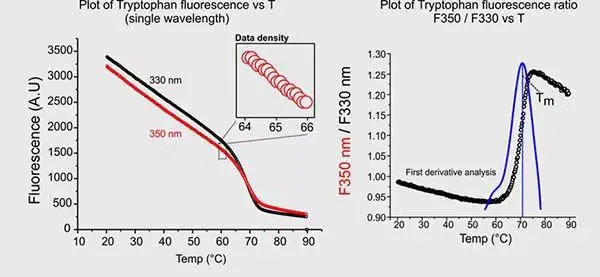
内源荧光测去折叠▲
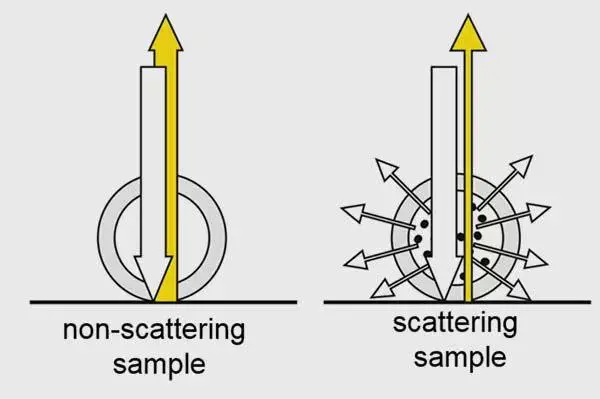
背向反射法测蛋白聚集▲

