ADC药物:需要解决的一些挑战
抗体药物偶联物(ADC)目前正处于快速发展阶段。这种药物利用抗体选择性地将细胞毒性药物输送到肿瘤部位。到目前为止,美国食品药品监督管理局(FDA)已批准了多个ADC,包括Kadcyla、Adcetris、Besponsa、Mylotarg、Lumoxiti、Polivy、Padcev、Trodelvy、Enhertu、Blenrep、ZYNLONTA和Tivdak。此外,目前有超过80种ADC正在进行研究,约150项临床试验正在对其进行评估。尽管ADC越来越受欢迎,但提高其治疗指数(即更高的疗效和更少的毒性)仍然是一个挑战。
药物研究与开发必须实现疗效与安全性的统一,两者缺一不可。迈乐替尼(Mylotarg)从上市到下架再到重新上市的经历充分说明了安全性在药物研究与开发中的重要性。大型制药公司从ADC的各种组分入手,以期获得具有高临床价值的ADC产品。然而,ADC药物作为一种非常复杂的实体,其临床转化成功与否仍面临诸多问题
复杂的药物动力学特征
在ADCs被输注后,它们主要以完整的ADC、裸抗和游离形式的毒素存在于体循环中,并随着ADC识别靶抗原、内化和解离这三种存在形式而动态变化。典型的ADC药代动力学表现为ADC被内化和抗体被清除时,结构完整的ADC和裸露抗体的浓度持续下降。影响抗体清除的因素包括单核吞噬系统和Fc受体(FcRn)介导的循环。通过将ADC结合在内吞泡中,FcRn将ADC排出到细胞外空间以供再次使用。因此,包括结构完整的ADC和裸露抗体在内的抗体通常具有比传统小分子药物更长的半衰期。至于细胞毒性载荷的游离形式,主要在肝脏代谢并通过尿液或粪便排出体外,这一过程可能受到药物相互作用和肝肾功能受损的影响。这些因素再加上患者个体差异,使得建立能够描述ADC临床特征的PK和PD模型并用于设计新型ADC变得十分困难。
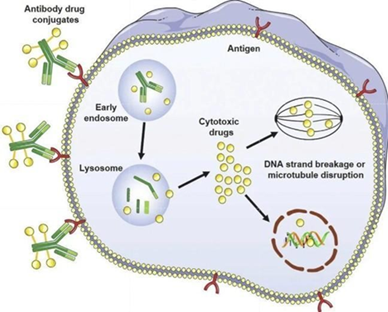
图示说明:ADC的内吞
ADC无法展示其优势。
尽管ADC获批数量不断增加,但在临床试验中已显示出优越安全性和有效性的ADC仍面临一些挑战。许多开发者在临床试验中面临的一个意想不到的挑战是,ADC无法显示出比对照组的更强的临床效果。例如以HER-2为靶点的MM-302在临床实验中并未比对照组在中位PFS更据优势。
I期HERMIONE试验(NCT02213744)因安慰剂治疗无效而终止。另一种报告类似情况的ADC药物是Rovalpitumab tesirine(RovA-T)。该药物在I期试验中取得了鼓舞人心的结果,评估患者的客观缓解率(ORR)为18%,而在高DLL3表达患者中,这一比例达到了38%(NCT01901653)。然而,由于II期试验TRINITY(NCT02674568)的结果未能达到主要终点,并报告了高毒性率,因此在安全性和有效性方面引发了担忧。患者中最常见的事件是胸腔积液,被认为与PBDE二聚体的毒性相关。最终,III期试验TAHOE(NCT03061812)和MERU(NCT03033511)的结果导致AbbVie完全停止了RovA-T的开发,因为与对照组相比,未显示出生存获益。
ADCs的不可避免的毒性副作用
抗体药物偶联物(ADC)面临的主要挑战之一是不可避免的毒副作用,这是由于细胞毒性小分子在血液中过早释放所引起的。“脱靶点、脱肿瘤”相关的不良事件似乎在大多数现有ADC的毒性反应中占主导地位。对现有数据的荟萃分析显示,不同药物负载的小分子具有独特的毒性谱,与靶抗原无关。抗体作为运输载体有其局限性,很难进入致密的肿瘤组织,据估计,只有0.1-2%的药物能到达肿瘤组织。为了确保其余99%的高毒性弹头不会引起全身性毒性,弹头与抗体之间的化学连接必须足够稳定。然而,为了在细胞内释放弹头,连接又不能过于稳定,这显然给药物设计带来了困难。
与此相关的风险增加程度取决于细胞毒性小分子的毒性特征。美登素(DM1)的非靶点毒性包括肝毒性和血小板减少症;MMAE与发生周围神经病变、中性粒细胞减少症和贫血的可能性相关;MMAF与眼部毒性相关。就ADC的代谢特性而言,ADC的亲脂性会因亲脂性小分子的高药物负荷而增加清除率。一项涉及异种移植模型的体内研究比较了不同DAR(2、4和8)的MMAE与CD30 mab偶联的ADC对ADC清除的影响。结果显示,药物负荷越高,清除率越高。在这项研究中,DAR为8的ADC清除最快。
在目前获批上市的15种抗体药物偶联物(ADC)中,最常见的3级或以上的严重副作用是血液毒性,包括中性粒细胞减少症、血小板减少症、白细胞减少症和贫血。非靶点毒性,如血液毒性、肝毒性和胃肠反应,可能与载药物质在血液循环、非肿瘤组织或肿瘤微环境中过早释放以及载药物质对健康组织的后续影响有关。这些副作用与传统化疗药物对快速增殖的健康细胞的影响是一致的。
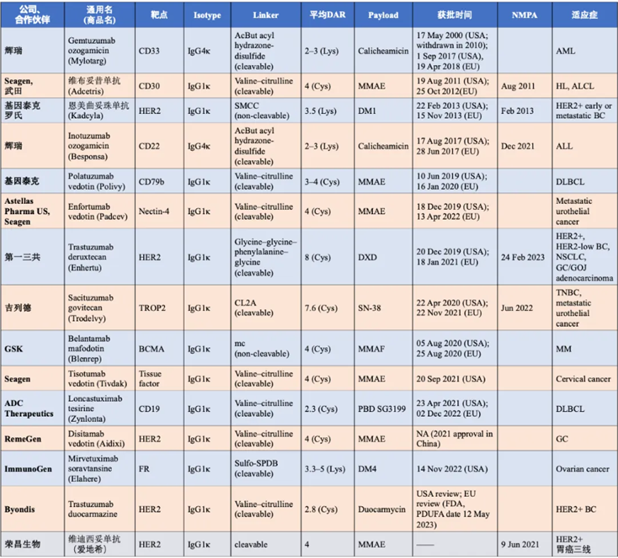
图示说明:已上市的ADC
ADCs肿瘤靶向与载荷释放
与传统化学毒药的小分子相比,由于抗体的连接作用,ADCs的分子量明显更大,这将限制ADCs穿透肿瘤微环境并到达肿瘤细胞的效率。据报道,只有0.1-2%的静脉注射ADC药物最终能到达肿瘤组织,因此在设计ADCs时需要考虑药物负载的毒性。
一方面,为了减少大多数毒性较高的药物对非肿瘤组织的全身统性毒性,抗体与药物之间的连接体必须足够稳定。另一方面,为了确保药物进入细胞后能够顺利释放,连接体又不能过于稳定,因此在设计ADC时需要权衡这些因素。
到达肿瘤组织后,ADC通过与抗原结合形成ADC-抗原复合物进入细胞内。带有酸性可切割连接体的ADC被运输到早期内涵体,而需要蛋白酶裂解的ADC被运输到晚期内涵体和溶酶体。靶抗原表达的高异质性对被内化至细胞内的ADC的抗肿瘤活性具有重要影响。在设计ADC时,选择非极性可切割药物载体可以有效地穿过细胞膜,更好地发挥ADC的“旁观者效应”,杀死不表达抗原的周围肿瘤细胞。
ADCs的聚合
此外,ADCs容易聚集。ADC的聚集会导致其与抗原结合能力降低的改变。
蛋白质聚集是ADC开发中的主要障碍。它可以发生在各个阶段,也可能在运输和长期储存过程中出现。聚集具有免疫原性。此外,蛋白质聚集还会导致产品损失。总体而言,任何化学或物理降解都可能导致ADC结构的变化,并引发过度的蛋白质聚集。还有其他各种因素可能导致聚集,例如频繁的冷冻/解冻、高蛋白质和盐浓度、升高的温度或低pH值。此外,大多数载荷是疏水性的,在蛋白质表面以高DAR(药物与抗体的偶联比)结合载荷可能会导致过度的蛋白质聚集,从而阻碍ADC的成功开发。在某些ADC中,载荷在打破现有二硫键后与Cys残基结合,导致疏水-疏水相互作用增强。
ADCs的药物耐受性
另一个挑战因素是药物耐药性。药物载体的内化及其有效性主要受到获得性耐药机制的影响,例如肿瘤细胞抗原表达下调。当治疗失败或效果降低,或者肿瘤细胞逃逸时,就会发生药物耐药。药物耐药可以在治疗开始时出现,也可以在药物治疗后出现。药物耐药性的产生有多种机制,其中包括:抗原表达水平下调、药物外排泵、内吞作用和迁移、有缺陷的溶酶体功能、改变的信号通路以及异常的细胞凋亡。
ADCs稳定的偶联方式
传统的随机偶联方法通过抗体的半胱氨酸或赖氨酸残基侧链进行(通过马来酰亚胺或酰胺偶联),是应用最广泛的方法。但随机有效载荷偶联通常产生可变的DARs(0-8),这导致治疗指数、药代动力学和稳定性特征的不可控性。此外,基于马来酰亚胺的偶联物的一个关键缺点是它们容易受到血液硫醇存在下的逆迈克尔脱偶联和过早的有效载荷释放。
鉴于以上诸多问题,利用定点偶联技术制备均一度高,稳定性好,具有更好的活性和药代学特性的ADCs是目前业内发展的主流方向。这些方式包括引入反应性半胱氨酸偶联、酶法修饰偶联等。Sortase A(货号IEN001)是目前在ADC领域使用较为广泛的工具酶。可特异性识别C端修饰的序列LPXTG,并使苏氨酸 (T) 和甘氨酸 (G) 之间形成新的肽键。通过这项技术,可以在抗体的重链和轻链的 C 末端引入了 LPETG 序列,与带有GGG的毒素偶联,从而实现抗体药物定点偶联。和传统的随机偶联方式相比,Sortase A(货号IEN001)介导的酶催化反应特异性更强,同时反应条件更加温和,在生理条件下(如中性pH、室温)即可发挥作用,避免了极端条件对蛋白质或底物的破坏,同时通过调节反应条件,可以精确控制Sortase A酶的催化反应,提高反应效率和产率。
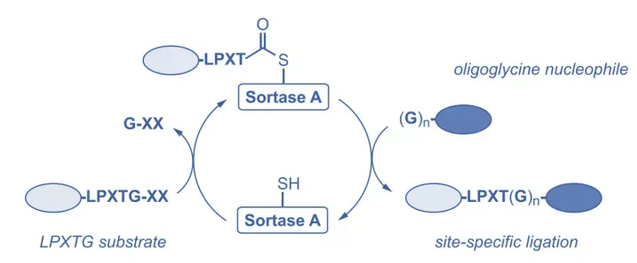
图示说明:Sortase A工作原理
结论
随着ADC开发过程的成功与激动人心,也伴随着复杂性和局限性。这是一个创新药物的时代,各种技术不断更新迭代,而ADC需要更广泛的临床覆盖面和确认,因为需要更深入地研究更多的问题。未来,ADC药物在抗肿瘤市场中具有巨大的潜力。爱康得生物是全球领先的纳米抗体偶联药物研发服务公司,可提供NDC全流程技术服务,解决纳米抗体偶联药物研发各阶段痛点问题,以支持客户的前沿研究。
- 上一篇: 50亿级爆款药

