从突破性疗法到仿制药再到改良药:HER2-ADC步入下半场
抗体-药物偶联物(adc)作为一种精准靶向的癌症治疗创新药物,最近获得市场准入的数量正逐渐增加。几十年来,ADC在靶向输送强效细胞毒素方面取得了重大进展,但在不断探究的过程中,由于各种原因如缺乏疗效、剂量限制毒性(Dose Limiting Toxicity,DLT)和整体狭窄治疗指数(therapeutic index,TI),局限了它们为患者带来益处的能力。
随着越来越多的治疗靶点被挖掘出来用于ADC候选药物,ADC的开发前景大大增加,包括靶点的多样性、适应症、不同偶联物和连接子选择的组合等。
不可否认的是,在所有这些ADC靶点中,HER2已经成为ADC药物狩猎者的沃土,尤以HER2-ADC界的先锋Kadcyla®和Enhertu®为代表,两者分别于2013年和2019年获FDA批准上市。这两种ADC都加入了曲妥珠单抗(赫赛汀®)作为单克隆抗体,除此之外,事实上多个在研ADC药物都使用了该抗体,下表概述了在 III 期阶段含有曲妥珠单抗的 [vic-]trastuzumab duocarmazine (SYD985) 以及其他曲妥珠单抗- ADC I 期候选药物和处于不同临床开发阶段的几个工程变体。在印度获批上市的 Kadcyla® 生物类似药补充了这一点,其他几个不同国家的在研ADC也遵循这一路线。
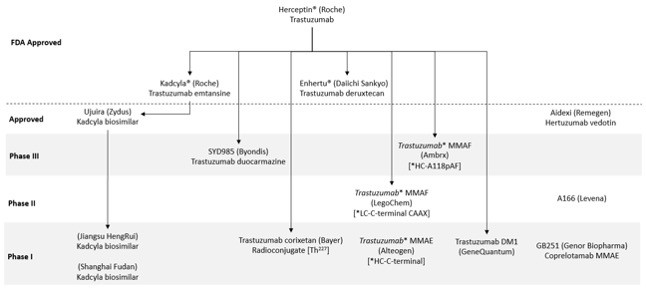
曲妥珠单抗和其他 HER2靶向 ADC 开发候选药物概述
与曲妥珠单抗相比,其他一些靶向HER2的ADC项目也在进一步扩展,其中中国获批的ADC Aidexi®使用了人源化IgG1抗体Hertuzumab,另外一些其他ADC正处于临床开发的早期阶段,使用了新型抗体。之所以将曲妥珠单抗的开发和以HER2为ADC的首选靶点的原因可能是基于临床前转化模型的深度和广度、赫赛汀的现成可用性和已批准的基准对照。
从Kadcyla®到Enhertu®之旅很有趣,它改进了一些关键的ADC设计,包括从不可切割连接子转变为可切割连接子,将细胞毒素的作用机制从抗有丝分裂的化疗药美登素DM1转变为拓扑异构酶I抑制剂DXd,并将药物-抗体比(DAR)从平均3.5的异质性分布提高到均一性DAR为8。这种较高的DAR旨在通过利用较低效力的细胞毒素来扩大TI。
由于ADC药物中采用的小分子药物有着较强的疏水性,DAR值过高时会引起ADC药物聚集,导致在体内循环半衰期减少以及毒副作用提高,因此,早期批准的最佳DAR值为4,为合适的TI设定了典范。第一三共靶向HER2的Enhertu®和Immunomedics靶向TROP-2的Todelvy®DAR均为8,显然超出4这个最佳点。之所以这些高DAR的ADC能够成功,是因为与有效载荷微管蛋白抑制剂Auristatins和DM1以及DNA烷基化蒽环类和PBD二聚体相比,它们的有效载荷的效力和疏水性较低,可以减少聚合和改善ADC的PK特性。
Enhertu®和Trodelvy®中增加的亲水连接子和能发挥旁观者效应的有效载荷,以及Trodelvy®在肿瘤微环境(TME)中增加的有效载荷释放,使得这些更高DAR的ADC与通过改进TI改善患者治疗相关。
同是使用了曲妥珠单抗的ADC,在III期HER2阳性转移性乳腺癌试验DESTINY中,Enhertu®与Kadcyla®的直接比较清楚地表明Enhertu®优于Kadcyla®。Enhertu®治疗的12个月无进展生存期(PFS)为75.8%,而Kadcyla®为34.1%,无疑,Enhertu®将在二线治疗中取代Kadcyla®。
Enhertu® 与 Kadcyla® 的不同之处在于其有效载荷作用机制,且前者在低表达或异质表达 HER2 肿瘤中临床疗效的改善是由更高的 DAR 和药物的稳定性特征驱动的。
此外,Kadcyla® 的剂量限制性毒性和与人周围神经病变相关的不可逆轴突变性在 Enhertu® 中未观察到,也有临床前数据显示Enhertu®在Kadcyla®耐药细胞系中具有良好的活性。
从Enhertu® 和 Trodelvy®的优秀TI可以发现,当前ADC玩家的游戏规则已被改变,它们的进步提供了更多潜在优势和更大的利益空间。
Enhertu® 和 Trodelvy® 中使用的马来酰亚胺接头的性质意味着DAR可达到8,这些更高 DAR的 ADC显示的增加载药量的潜力,预示着下一代 ADC 颠覆性技术可能会克服这些限制,进一步推动高 DAR ADC 的界限。因此,如果DAR增加到超过8个有效载荷时,则应伴随接头-有效载荷疏水性的降低,如果预计抗原拷贝数较低,则应根据有效载荷的旁观者效应进行调整。
综上所述,有业界人士认为,HER2 靶点ADC可能尚未达到饱和,鉴于临床候选药物的不断扩大和曲妥珠单抗生物改良药的持续开发,以及ADC生物仿制药的潜力,针对HER2 ADC的研究将继续上升。
- 上一篇: 基于纳米抗体的CAR-T细胞疗法
- 下一篇: 50亿级爆款药

