纳米抗体筛选平台,助力肿瘤免疫药开发
2018年,诺贝尔生理学或医学奖授予了两位免疫学家詹姆斯·艾利森(James Allison)与本庶佑(Tasuku Honjo) ,以表彰他们在癌症疗法以及免疫负调控的抑制领域所作出的贡献。在此之前,相关的临床发展并不迅速,“免疫检查点疗法”彻底改变了癌症治疗方法,并从根本上改变了我们对待癌症治疗的方式。
詹姆斯•艾利森和本庶佑发现的CTLA-4和PD-1能够抑制人体的免疫反应,而它们的抑制剂则能激活人体自身免疫系统攻击肿瘤细胞从而治愈相关癌症,是一种全新的癌症治疗方法。自CTLA-4和PD-1发现以来,针对它们的抑制剂成为抗击癌症的药物热点,而针对这两个靶点的阻断抗体则成为热点中的热点。譬如首先上市的肿瘤免疫药物Nivolumab(商品名Opdivo,简称O药,也叫纳武单抗)和Pembrolizumab(商品名Keytruda,简称K药,也叫派姆单抗),均是PD-1抑制剂。O药和K药已在80多个国家获批使用,覆盖了黑色素瘤,非小细胞肺癌,头颈癌,霍奇金淋巴瘤,膀胱癌,宫颈癌,胃癌等。
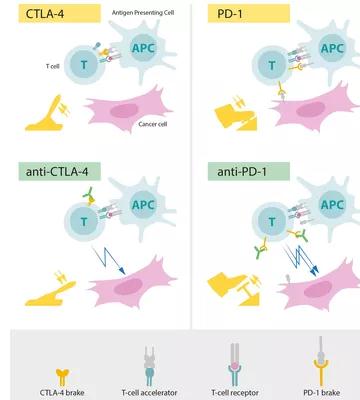
抗体药物前景巨大,但还有很大发展空间
自首个PD-1抗体药物上市以来,以PD-1为基础的临床用药研究也已获得令人振奋的数据,越来越多的人对肿瘤免疫治疗抱有极大信心,然而PD-1的研发还是有不足的,PD-1单抗虽是广谱抗肿瘤药,但只适用部分癌症。PD-1单抗也存在原发性耐药和获得性耐药。
另外,在使用过程中也存在较大的个体差异,部分患者获得了显著的效果,但部分患者的效果却不怎么理想。譬如O药和K的适应症都有限,因此,寻找新的更为有效的抗体或联合多药物或许能够扩大现有药物的适应症。
近年来,纳米抗体(单域抗体)就被认为在抗肿瘤治疗方面蕴藏巨大潜力。
纳米抗体:一种小型的新型抗体
纳米抗体最早由比利时科学家 Hamers 等1993 年在《Nature》首次报道。在羊驼外周血中存在一种天然缺失轻链的抗体,该抗体只包含一个重链可变区(VHH)和两个常规的CH2与CH3区,该抗体是已知的可结合目标抗原的最小单位。VHH晶体为2.5nm,长4nm,分子量只有15KD,因此也被称作纳米抗体(Nanobody或single domain antibodody)。
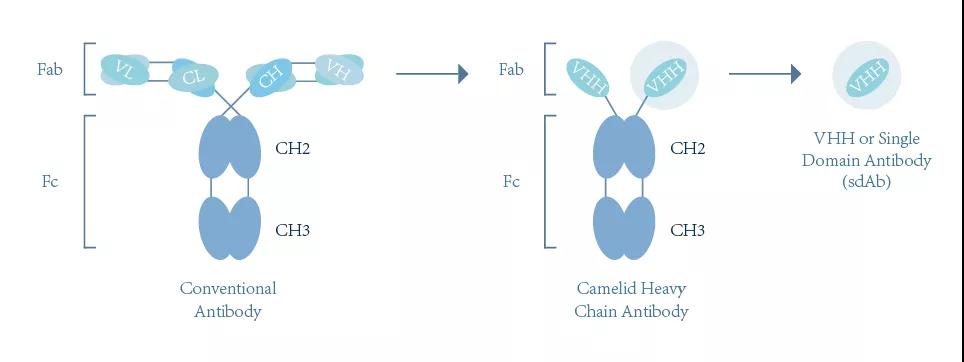
纳米抗体结构
纳米抗体晶体宽为2.5nm,长4nm,分子量仅为传统完整抗体的1/10(约15KD)但依然具有完整的抗原识别能力,一般通过噬菌体筛选得到完整抗体序列。得益于纳米抗体微小的结构、完整的抗原识别能力以及噬菌体筛选技术,纳米抗体表现出高亲合力、高特异性、强穿透性和易于改造和表达等特点,并且由于可以获得抗体完整序列,纳米抗体可以通过体外重组表达高质量稳定生产,有效避免传统抗体的批次间差异问题。
和传统抗体相比,纳米抗体分子量小,结构简单。而得益于分子量小的优势,纳米抗体更进一步具有多个特征,使得纳米抗体在抗肿瘤治疗方面表现出巨大的潜力:
① 和靶点结合特异性更强;
② 更高的组织穿透力;
③ 更高的稳定性;
④ 适合工业化大规模生产;
⑤ 更容易体外改造和优化;
⑥ 更容易人源化
纳米抗体的获得
噬菌体展示技术一直是获得纳米抗体序列的重要技术路径之一。其原理是将外源蛋白质的DNA序列插入到噬菌体外壳蛋白的一个基因上,使外源基因随着外壳蛋白的表达而表达,最终蛋白以与外壳蛋白融合的形式展示在噬菌体表面。被展示的蛋白或者多肽可以保持相对的空间结构和生物活性,因而可以利用靶蛋白对其进行筛选。
但是,利用这种技术获得纳米抗体序列存在一定的限制,如部分抗体无法正确的与噬菌体衣壳蛋白融合并展示出来,且噬菌体自身与靶蛋白的非特异性结合也会影响后续筛选工作的进行等。为了解决这类问题,近年来,科学家们正尝试采用基于酵母展示和singleB细胞克隆这两种技术路线,来实现快速、有效获得纳米抗体的目的。
掌握核心技术,抢占发展高地
在这一背景下,致力于纳米抗体研发的爱康得生物也建设了另外两条技术路线:酵母展示库和Single B细胞克隆。其中,基于酵母展示获得纳米抗体的技术路线是将纳米抗体展现于酵母表面,通过FACS分选阳性克隆后,通过测序获得多样化的抗体序列。这种方法可以极好的模拟所有纳米抗体在细胞膜表面的结构,正确反应纳米抗体与抗原的结合情况,极少出现噬菌体展示库常见非特异性结合的情况。
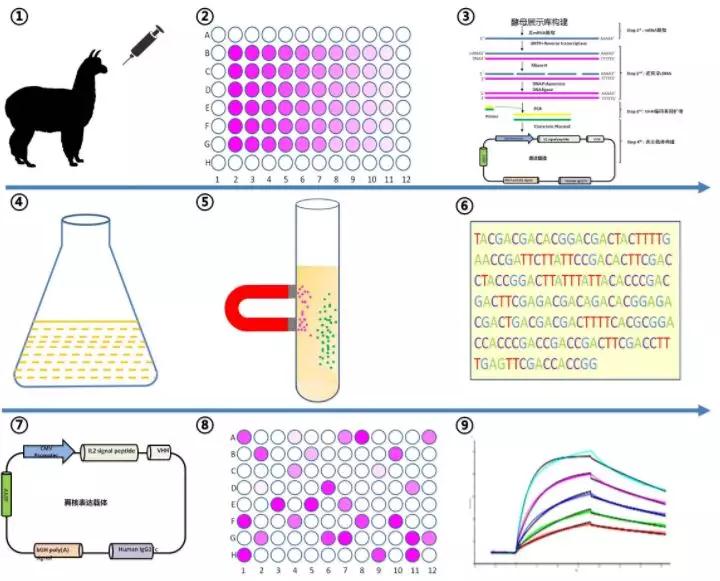
酵母展示获得纳米抗体技术主要步骤:
①② 羊驼免疫与效价检测
使用重组蛋白对羊驼进行免疫,并进行效价检测
③④ 纳米抗体酵母展示库构建
采集外周血,分离PBMC细胞;提取RNA后,制备cDNA样品。从制备的cDNA样品中克隆纳米抗体基因编码序列,并克隆至酵母展示载体中,制备酵母展示库,随机挑取克隆,对酵母展示库的容量以及库的多样性进行评估。
⑤-⑦ 纳米抗体筛选
使用靶蛋白偶联的磁珠分选阳性酵母菌群,并对单克隆酵母菌落进行测序,以获取候选的纳米抗体序列。
⑧ 纳米抗体表达验证
将获取的纳米抗体编码区序列信息,构建真核表达载体进行验证。
⑨ 纳米抗体亲和力测定
采用Biacore T200,检测筛选的纳米抗体与目标蛋白的亲和力。
除上述方案之外,为了满足更多研发需求, 爱康得生物还开发了基于Single B细胞克隆为基础的纳米抗体筛选平台。
ABexpressTM是爱康得生物自主研发的抗体快速筛选平台,该方案通过流式分选PBMC中对靶蛋白具有特异性结合的B细胞,并对单个B细胞进行抗体编码区域的测序最终获得抗体序列信息。这种方法适用于任意动物抗体筛选,可一次性覆盖全部靶向抗原特异性的B细胞,具有基因多样性好、效率高的特点;并可避免使用噬菌体库筛单克隆抗体过程中的假阳性,或非特异性结合等问题,提高纳米抗体筛选速度。

Single B细胞克隆获得纳米抗体技术主要步骤:
①② 羊驼免疫与效价检测
使用重组蛋白对羊驼进行免疫,并进行效价检测
③ PBMC分离及Single B细胞分选
采集免疫羊驼外周血,分离PBMC细胞;使用多种荧光标记的靶蛋白标记后,采用分选流式分离单个B细胞。
④ 纳米抗体克隆及测序
从单个B细胞提取RNA,逆转为cDNA后,使用纳米抗体扩增引物进行PCR,获取纳米抗体序列信息。
⑤ 纳米抗体表达验证
将获取的纳米抗体编码区序列信息,构建真核表达载体进行验证。
⑥ 纳米抗体亲和力测定
采用Biacore T200,检测筛选的纳米抗体与目标蛋白的亲和力。
总结
作为一类新型的抗体结构,纳米抗体除了具有与传统IgG型抗体不同的优势,也可用于构建双特异性抗体,利用这些优势来探索纳米抗体在助力肿瘤免疫药物开发等用途上将成为一个创新点,并拓展抗体药物的市场空间。
目前,从全球范围来看,很多大药企和生物技术公司已经悄然布局纳米抗体,且有不少已经运作了多年。譬如首屈一指的比利时药企Ablynx,其作为最先注册使用纳米抗体一词的公司,在纳米抗体开发领域的绝对权威,已经在纳米抗体领域申请的专利超过500项;与此同时,中国也有企业在积极开发纳米抗体。而另一方面,提供纳米抗体的CRO数量也逐渐增多,侧面说明了该领域的发展潜力。在此环境之下,爱康得生物身为一家专注于CRO服务的技术型企业,也将在今后为持续发热的纳米抗体领域再添动力。

