Science突破成果:CAR-T+RNA疫苗,实体瘤终于被拿下!
前言:
CAR-T疗法自诞生以来,已在治疗血液瘤中取得赫赫战绩。这种疗法是从患者体内分离出免疫T细胞,然后通过基因编辑的方法,给它们装上一种叫做“CAR”的导航仪。后者会让免疫细胞更精准地识别癌细胞,并对它们发起攻击。
然而在实体肿瘤应用中,这一疗法一直面临多种瓶颈。其中一个挑战就是,实体瘤上缺少让免疫细胞识别的“导航地址”。导航地址模糊自然无法找到癌细胞,这也就导致CAR-T疗法在实体瘤治疗中效果有限。
近日,Science发表的一篇文章中,研究人员终于找到了这个专属癌细胞的“导航地址”——CLDN6,一种表达在细胞表面、能够让细胞紧密连接在一起的蛋白。不仅如此,为了增强对癌细胞的感应,使T细胞大量扩增,研究人员还设计了一种纳米颗粒RNA疫苗(旨在将CAR抗原在全身范围内传递到淋巴区室),进一步提高了抗癌效果。
以下为Science原文部分摘译:
为了评价CLDN6作为CAR-T细胞治疗靶点的适用性,研究人员对其在人和小鼠组织中的表达进行了分析。在小鼠中,CLDN6被发现是一种调节性蛋白。通过免疫组化(IHC)染色,研究者发现CLDN6在胎儿器官中广泛表达,但在出生前下调,导致成年小鼠大部分器官中缺乏表达;在人类中,来自胃、胰腺、肺和肾的胎儿组织中CLDN6转录水平很高,但在相应的成人组织样本中检测不到。研究人员们分析了来自健康成人的50多种不同的组织类型,发现都没有CLDN6。但是IHC染色显示,CLDN6蛋白在各种人类实体癌,如睾丸癌、卵巢癌、子宫癌和肺腺癌中表达。
这些发现表明CLDN6是一种严格意义上的癌胚细胞表面抗原,具有理想的CAR-T细胞靶向表达谱。
CLDN6靶点验证
这项研究设计了具有4-1BB共刺激信号域的二代CLDN6-CAR。对于受体结构域,研究者设计了与CLDN6高特异性结合的单链可变区片段。首先,他们对CLDN6-CAR工程化的人类T细胞进行了体外鉴定。使用递增量的CLDN6
RNA转染COLO699N人肺癌细胞,并评估其是否被CAR-T细胞杀伤,研究者观察到,CLDN6-CAR对转染了CLDN6的细胞具有很强的识别和裂解能力(图1 C,D)。






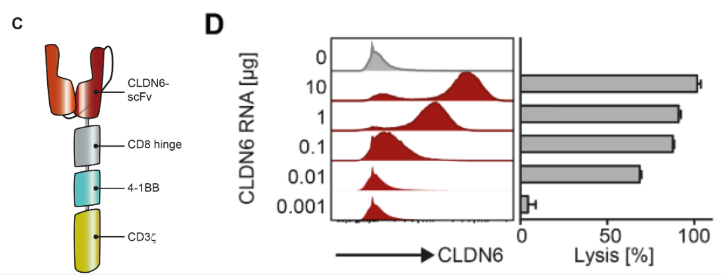
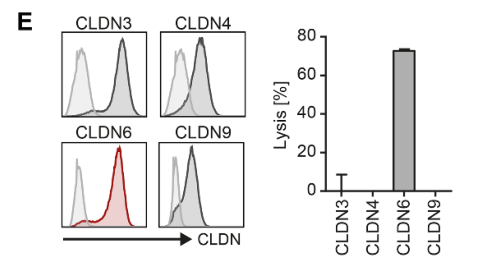
在同类型实验中,研究者还评估了CLDN-CAR对CLDN3、CLDN4和CLDN9等Caldin家族成员的交叉识别,发现只有CLDN6转染的靶细胞被杀死,被其他claudins转染的靶细胞则未被杀死,说明CLDN6-CAR-T细胞的精确靶向性(图1E)。
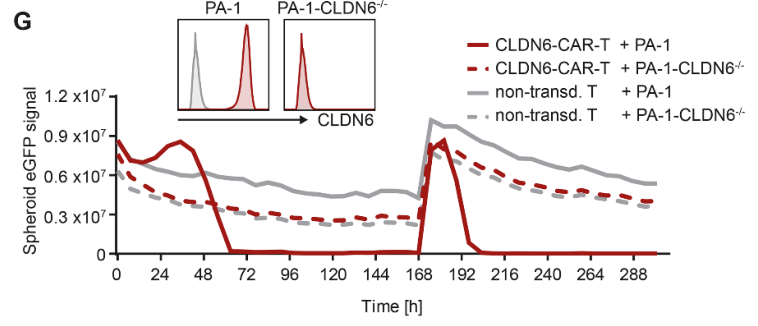
为了检测同源免疫激活,研究者将CLDN6-CAR-T细胞与人类肿瘤细胞系共培养。发现在与CLDN6阳性靶细胞共培养时,T细胞活化标记物的干扰素-γ(IFNγ)分泌和上调,但CLDN6阴性细胞没有。CLDN6-CAR-T细胞能有效清除CLDN6阳性PA-1卵巢癌球体,并在再次激发时进行重复杀伤。通过CRISPR/Cas9敲除CLDN6后,CAR-T细胞无法识别PA1,进一步证实了CLDN6-CAR-T细胞的高效性和特异性(图1G)。
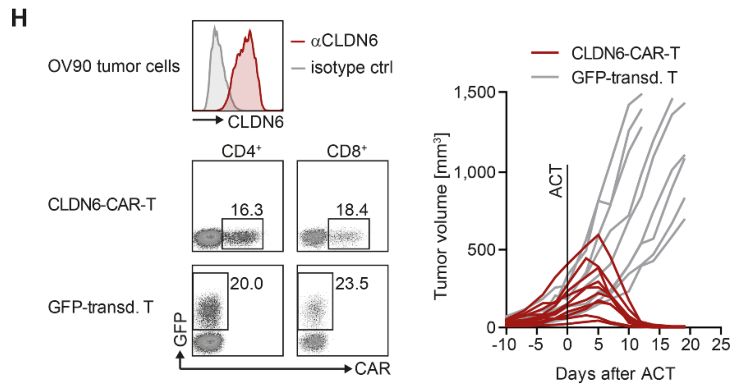
其次,他们研究了人CLDN6-CAR-T细胞在小鼠皮下移植人肿瘤细胞株后的体内抗肿瘤活性。值得注意的是,小鼠不是研究这种CAR毒性的合适物种,因为CLDN-CAR与小鼠CLDN6同源性的结合亲和力比人CLDN6低15倍,另外,研究还发现人CLDN6仅在胚胎阶段表达,而小鼠CLND6还在一些胚后发育细胞组织中表达。对患有OV90人卵巢癌细胞的NSG小鼠进行单剂量人CLDN6-CAR-T细胞治疗,结果发现,与癌进展迅速的对照组相比,所有经CLDN6-CAR-T细胞治疗的小鼠在2周内肿瘤完全消退。在治疗后25天的整个观察期内,可在治愈小鼠体内检测到循环CLDN6-CAR-T细胞(图1H)。
众所周知,CAR-T细胞的移植成活率和持久性对其临床效果至关重要。在血液肿瘤中,CAR-T细胞直接作用于B细胞的髓系抗原,并以宿主B细胞为靶点。它们作为抗原呈递细胞(APCs)提供强大的增殖信号并促进CAR-T细胞的持久性。
然而,在实体肿瘤环境中,由于CAR-T细胞在实体病变中接触肿瘤细胞的可及性受损,以及CAR-T细胞在免疫抑制肿瘤微环境中遇到靶点时缺乏增殖信号,因此CAR-T细胞的频率(frequency of CART cells)通常会迅速下降。研究者假设,在淋巴组织的APCs表面以其天然构象表达CAR靶点,将使其在最佳免疫活化环境中可用来刺激同源CAR-T细胞。
RNA疫苗加持
在这项研究中,作者们介绍了一种静脉注射的脂质体抗原编码RNA(RNA-LPX)来刺激患者的肿瘤相关T细胞。这种纳米颗粒疫苗将抗原传递到脾脏、淋巴结和骨髓中的APCs,同时启动Toll样受体依赖性I型干扰素驱动的免疫刺激程序,促进抗原特异性T细胞的启动和强扩增。
为了测试这种方法是否能作为扩增CAR-T细胞的RNA疫苗(以下简称CARVac),研究者进行了一系列实验。首先,他们检测了CLDN6在树突状细胞(DCs)上能否在体外刺激CLDN6-CAR-T细胞。根据编码RNA-LPX的CLDN6(CLDN6-LPX)浓度梯度实验,研究者测量了DCs上CLDN6的浓度表达。然后得出,CLDN6在DCs上的表达以剂量依赖性的方式诱导共培养CLDN6CAR-T细胞的刺激、细胞因子分泌和增殖。当给BALB/c小鼠静脉注射CLDN6LPX后,研究者在脾脏DCs和巨噬细胞上检测到CLDN6的表达,但在淋巴细胞上未检测到CLDN6表达,这证明CAR抗原仅在体内传递给APCs。此外,注射RNA-LPX的小鼠脾脏和淋巴结中还被检测到NK、B和T细胞的强激活。
为了验证CARVac对实体瘤的普适性,研究者选择了CLDN18.2——Claudin家族中一个与癌症相关的成员,在胃食管癌和胰腺癌中表达。研究者设计了一个CLDN18.2-CAR,将CLDN6特异性单链抗体替换为antiCLDN18.2单链抗体。CLDN18.2CAR-T细胞具有与CLDN6-CAR相似的功能特征,包括体外抗原特异性激活、杀伤肿瘤细胞。与经CLDN18.2-LPX处理的DCs共培养的CLDN18.2-CAR-T细胞也显示同源激活和增殖。证明RNA疫苗可被成功用于增强靶向CLDN18.2的CAR-T细胞的疗效。
接下来,研究者在一系列小鼠实验中研究了CARVac的体内性能。
对Thy1.2+C57BL/6小鼠全身照射(TBI)进行淋巴清除,然后植入同源Thy1.1+CLDN6-CAR-T细胞共表达Luc和GFP,随后接种CLDN6LPX。体内成像结果显示,单次静脉注射CLDN6-LPX诱导了循环CLDN6-CAR-T细胞的显著扩增。这种扩增与RNA-LPX的剂量水平相关,即使在最低剂量为0.625μg的RNA-LPX时,这种扩增也是显著的。此外,对小鼠外周血T细胞进行的定量和表型分析证明,Thy1.1+CAR-T细胞出现活化表型的频率增加(KLRG1hi, CD62Llow),而内源性T细胞在任何剂量的RNA-LPX处理后都未受到影响。CAR-T细胞数量在接种RNA-LPX后的3-4天达到峰值,随后开始下降(图2 A,B)。
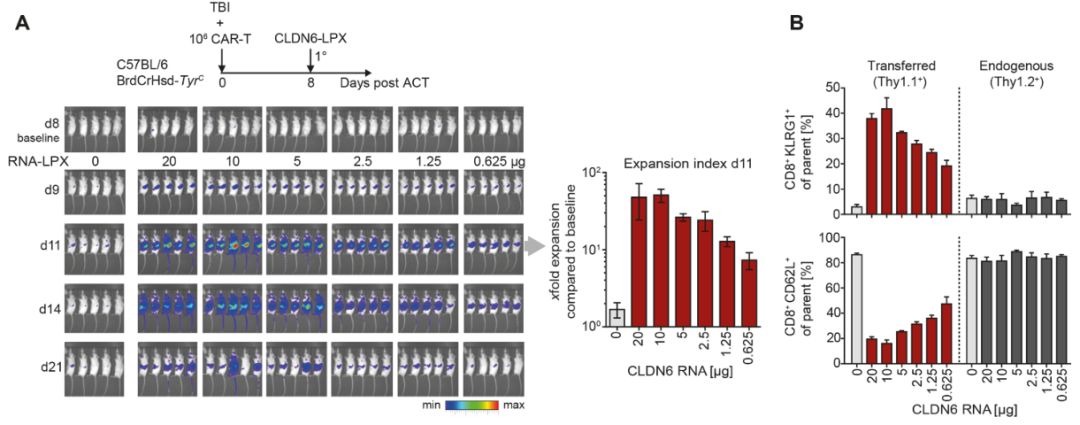
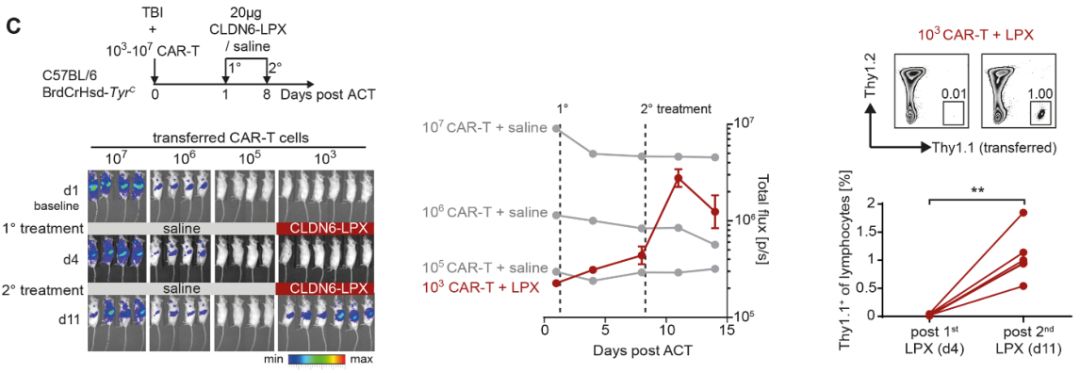
在另一项实验中,几组小鼠接受了起始剂量为103cell/animal剂量的CLDN6-CAR-T细胞,之后对各组小鼠进行前者单药治疗或CLDN6-CAR-T细胞+CLDN6-LPX方案治疗。结果显示,在未接受CLDN6-LPX的小鼠中,原代CAR-T细胞的移植成活率与过继转移细胞的数量呈线性相关,并随时间保持稳定或缓慢下降。值得注意的是,在使用CARVac治疗的小鼠中,CAR-T细胞在不考虑起始剂量的情况下出现扩增。正如大多数转移的T细胞上Ki67的瞬时上调所表明的那样,几乎整个CLDN6-CAR-T细胞群体都受到RNA-LPX的激活和增殖,且RNA-LPX扩增的CLDN6-CAR-T细胞功能完整。与从未接种疫苗小鼠中分离的CAR-T细胞相比,它们产生更高水平的IFNγ,并且在与CLDN6阳性肿瘤细胞体外共培养时,表现出更高且严格依赖抗原的细胞溶解活性(图2C)。
持久性、CRS和T细胞耗竭
为了评估重复接种RNA-LPX疫苗对CAR-T细胞持久性的影响,CLDN6-CAR-T细胞移植小鼠接受了三周剂量的RNA-LPX,然后再接受两次更长时间无治疗间隔的RNA-LPX(4周和4.5周)。数据显示,第一次接触CLDN6LPX后,CAR-T细胞迅速扩增了两个数量级,随后的每周处理使CAR-T细胞保持在较高水平。对于CLDN6-LPX治疗间隔延长至35天的治疗组,CAR-T细胞扩增有所下降。在未接种疫苗的小鼠中,CAR-T细胞的数量并未下降到植入量的基线水平,而是稳定在10倍以上的频率。在每一治疗间隔后,CLDN6-LPX可使CLDN6-CAR-T细胞稳健地扩增,表明CAR-T细胞的记忆形成。
细胞因子释放综合征(CRS)是CAR-T细胞疗法中最突出的急性不良反应。为了探讨与CARVac策略相关的全身细胞因子释放增加的可能性,研究者分析了轻度预处理CLDN6-CAR-T细胞移植小鼠暴露于CLDN6-LPX后,IFNγ、IL6和TNFα的血清浓度。结果显示,仅IFNγ值表现出早期轻度和短暂升高。且经治疗的小鼠外观正常,随时间推移体重有规律增加。
由于反复使用RNA-LPX和细胞毒性T细胞效应器(cytotoxic
T cell
effectors)的强扩增可能会导致淋巴组织中APCs的耗竭,研究者分析了RN-LPX暴露水平最高的的小鼠脾脏。然后得出暴露于单一或重复剂量RNA-LPX的脾脏未出现任何明显的病理改变。重复RNA-LPX处理后,使用流式检测不同时间点脾脏细胞组成,发现CD11c+
DC、F4/80+巨噬细胞数量轻度、短暂性减少,T细胞、B细胞、NK细胞数量无明显变化。从对应的时间点来看,脾组织切片中APC亚群的细胞分布没有变化。
最后,作者们研究了RNA-LPX对CAR-T细胞治疗荷瘤小鼠的影响。对患有CLDN6LL/2-LLc1
Lewis肺癌的淋巴衰竭C57BL/6小鼠注射亚治疗剂量的CLDN6-CART细胞后,再单次注射CLDN6-LPX或对照。分析表明,单独使用CLDN6-CAR-T细胞治疗,并不能完全控制肿瘤,肿瘤没有消退,只能让肿瘤生长延迟。相比之下,接受CAR-T细胞+CLDN6-LPX疫苗的10只小鼠中,有6只小鼠的大肿瘤被完全控制,中位生存期显著升高。研究者随后在CLDN18.2-LPX+CLDN18.2
CAR-T细胞治疗CT26结肠癌小鼠中重现了这一结果,进一步支持了CARVac对CAR-T细胞的抗肿瘤作用(图3 A,B)。
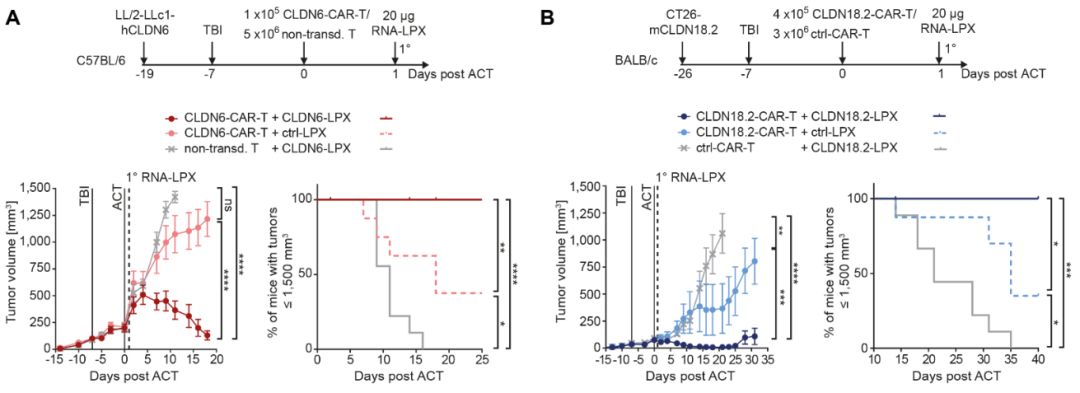
之后,研究人员又在卵巢癌异种移植小鼠模型中测试了CLDN6-LPX对人类CLDN6-CAR+ T细胞的影响,结果显示,疫苗联合亚治疗剂量(105/ animal)人类CAR-T细胞治疗完全抑制了晚期肿瘤,而接受人类CAR-T细胞单药治疗的小鼠肿瘤迅速进展(图4D),与CLDN6-CAR-T细胞一样,在小鼠异种移植模型中,人CLDN18.2-CAR-T细胞与CLDN18.2LPX再次验证了这些发现。
总结来说,这项研究建立了两个关键发现。首先,作者们揭示了CLDN6作为CAR-T疗法治疗实体瘤理想靶点的潜力。其次,CARVac可作为提高CAR-T细胞抗肿瘤效果的途径。这些研究数据证实了RNA-LPX刺激的CAR-T细胞在抗原识别后的细胞因子反应和细胞溶解活性方面优于非刺激的CAR-T细胞。它们形成记忆T细胞,并以更高的频率持续存在。CARVac不仅能促进CAR-T细胞的植入存活率,而且能在较低的CAR-T细胞剂量下控制治疗性肿瘤。
参考资料:K. Reinhard et al.An RNA vaccine drives expansion and
efficacy of claudin-CAR-T cells against solid tumors. Science, DOI:
10.1126/science.aay5967
- 上一篇: 盘点2019 | 那些让人惊呆下巴的奇葩医学案例!
- 下一篇: 纳米抗体筛选平台,助力肿瘤免疫药开发

