一文看尽纳米抗体在肿瘤领域中的应用(下)——成像与疫苗
3 纳米抗体用于成像诊断
分子成像已成为癌症研究中的重要工具,既可以用于了解疾病的潜在生物学,也可以用于诊断和治疗。分子成像需要用诊断放射性同位素标记的靶向部分或合适的荧光团。放射性标记的单克隆抗体已被广泛用作靶向部分,但其有效性受到 Ig 的大尺寸及相对较长的循环半衰期的限制。尽管如此,用于治疗的常规全人源单克隆抗体已被转化为显像剂。这种策略具有明显的优势,即批准用于临床的药物只需稍加修改即可用于成像目的,并且免疫原性和意外不良后果的风险最小,尤其是考虑到适量的显像剂给药。直到最近,纳米抗体才被用于首次人体试验。除肾脏外,非靶向器官对放射性标记纳米抗体的吸收通常较低,导致给药后不久靶标与背景的比率很高。这使得当日成像和使用寿命较短的放射性同位素成为可能,这与用于相同目的的 89Zr 标记的全尺寸单克隆抗体给药后不久发现的低靶标与背景比形成对比。这些特性解释了为什么纳米抗体被用于分子成像技术,如正电子发射断层扫描 (PET) 、单光子发射计算机断层扫描 (SPECT)、近红外荧光成像 (NIR) 和超声分子成像。
3.1 PET成像
成像使用正电子放射示踪剂。正电子在组织中与电子碰撞,并产生光子形式的能量,可以被PET扫描仪检测到。同位素标记的Igs和Ig片段作为PET显像剂,在体内对选定的靶标显示出极好的特异性。EGFR 靶向7D12 纳米抗体,用 68/67Ga 或 89Zr 放射性标记,是首批用于 PET 成像的纳米抗体之一。A341 荷瘤小鼠的 PET 图像显示肿瘤清晰可见,具有良好的肿瘤背景对比度 [1]。一些抗 HER2 纳米抗体也被用于成像目的,其中先导化合物 2Rs15d已经进行了一些详细的研究。纳米抗体与 68Ga-NOTA 结合后,可获得SKOV3 荷瘤大鼠肿瘤的高对比图像 [2]。这种纳米抗体的使用也已成功转化为临床应用,68Ga-NOTA-2Rs15d在人体内I期研究中首次用于her2过表达癌症患者的PET/CT扫描。基于纳米抗体的显像剂在患者的原发灶和/或转移灶中表现出良好的生物分布和高积累以及无副作用,表明其安全性和临床潜力。目前已经启动了两项使用这种示踪剂的II 期研究,以评估其检测乳腺癌患者局部和远处转移的潜力(clinicaltrials.gov、NCT03331601 和 NCT03924466)。除了her2位点外,在 3LL-R 荷瘤小鼠中使用抗 MMR 纳米抗体 3.49 的类似方法也取得了同样令人鼓舞的结果,有望用于 I 期和 II 期临床试验 (clinicaltrials.gov, NCT04168528) 。
由于肿瘤经常被骨髓源性抑制细胞 (MDSC) 浸润,因此通过 PET 对肿瘤微环境 (TME) 内的骨髓区室进行成像被认为是一个理想的目标。用抗 PD-1 和抗 CTLA4 等免疫检查点阻断抗体治疗改变了肿瘤治疗的格局,同时也可以影响肿瘤内骨髓细胞的分布。因此,对肿瘤内的髓样区室进行成像有助于了解对癌症免疫疗法的反应。经修饰用作PET显像剂的纳米抗体现已应用于临床前模型中的多种靶点,包括 II 类 MHC、PD-L1、CTLA-4、纤连蛋白 EIIIB、CD8、CD11b 、CD36 和 CD45 ,涉及肿瘤模型包括小鼠 B16 黑色素瘤、PANC02 胰腺癌、MC38 结肠直肠腺癌和 C3.43 人乳头瘤病毒诱导的癌症模型。所有这些药物都是通过在TME中存在髓样细胞和淋巴细胞来观察肿瘤的。
3.2 SPECT 与 Micro-CT 成像
单光子发射计算机断层扫描 (SPECT) 成像使用伽马发射放射性同位素。以 99mTc 标记的 EGFR 靶向纳米抗体 7D12 和 7C12 已用于 SPECT 和Micro- CT 应用。两种纳米抗体对 A431 异种移植小鼠的肿瘤均有明确定位 [3]。在另一项研究中,使用 99mTc 标记的抗 EGFR 纳米抗体 8B6 进行的 SPECT 成像在携带 DU145 和 A431 肿瘤异种移植物的小鼠中也显示出良好的肿瘤定位[4]。此外,通过SPECT 和 Micro-CT 评估 99mTc-2Rs15d 的肿瘤积累时,研究者观察到 HER2+ SKOV3 或 LS174 T 异种移植小鼠的肿瘤部位显示出明显的聚集,而在 HER2- 异种移植的小鼠肿瘤中未观察到 99mTc-2Rs15d 的肿瘤定位 [5]。99mtc标记的NbCEA5经总针孔SPECT和Micro-CT评估显示,在移植的LS174 T小鼠中,该NbCEA5能快速清除血液,并能有效靶向肿瘤[6]。无独有偶,使用针孔 SPECT 和 Micro-CT 成像对99mTc 标记的抗 MMR 纳米抗体 cl1在TS/A 和 3LL-R 荷瘤小鼠中的肿瘤靶向潜力进行评估也得到证实 [7]。还有在针对大热靶点PD-L1的研究中,SPECT成像显示99mtc标记的抗PD - L1纳米抗体在小鼠黑色素瘤和乳腺癌的PD-L1过表达肿瘤模型中具有强烈和特异性的吸收 [8],这一结果已在一项针对 16 名非小细胞肺癌 (NSCLC) 患者的 I 期临床试验中得到应用,99mTc 标记的抗 PD-L1 纳米抗体可以清晰地显示出原发性 NSCLC 肿瘤和转移,同时呈现出良好的生物分布和有限的副作用 [9]。
3.3 近红外荧光成像
同位素标记显像剂的使用有一个明显的缺点,即患者和医生都有辐射暴露的风险。具有高正电子产率的寿命较短的同位素,例如 18F,原则上允许在给药后不久进行成像,但受限于组织的穿透性和靶向性等因素,因此,不依赖于使用放射性同位素的方法仍然是有吸引力的替代方法。靶向HER2的纳米抗体 11A4 与近红外荧光团 IRDye 800CW 结合,特异性定位于携带 HER2+ SKBR3 异种移植小鼠的肿瘤部位,同时保持良好的生物分布。近红外荧光成像 (NIR) 已被用于实现图像引导手术以精确切除 HER2+ 肿瘤。在临床环境中,这种 NIR 偶联的抗 HER2 纳米抗体应该能够对 HER2 阳性肿瘤进行特定的非侵袭性分类和更精确的手术肿瘤切除。类似的方法还被用于标记靶向 EGFR 的纳米抗体 7D12,NIR 荧光识别出 OSC-19 舌肿瘤,活组织切片荧光成像显示纳米抗体定位于颈部淋巴结转移 [10]。
在其他针对不同肿瘤成像相关研究中还证明了,靶向CAIX的纳米抗体 B9 被证明在原位乳腺癌异种移植小鼠模型中产生可接受的图像;使用近红外荧光染料IRDye 800CW标记 的 2Rs15d 纳米抗体,NIR 荧光图像引导手术有助于在 SKOV3 异种移植小鼠中精确切除卵巢肿瘤 [11];抗 ARTC2 纳米抗体 S+16a 与荧光染料 AlexaFluor-680偶联,可用于小鼠 ARTC2 阳性肿瘤的体内 NIR 成像和离体解剖 [12]。
综上所述,这些例子表明,利用纳米抗体作为靶向部分的基于荧光的方法具有相当大的潜力,既能够表征肿瘤微环境,还可以作为物理消除肿瘤手术的辅助手段。需要指出的是,在一项比较随机标记和位点特异性标记的 2Rs15d 纳米抗体生物分布的研究中报道了不同共轭策略对纳米抗体性质的影响,这在开发基于纳米抗体的荧光成像剂时应加以考虑[13]。
3.4 超声分子成像
分子成像的一个广泛分支是以超声为基础的。微泡或纳米泡可用作超声造影剂。纳米气泡可以具有各种类型的壳(聚合物或磷脂)和核(气体、液体或固体),它们可以携带针对肿瘤相关抗原的特异性抗体,有助于不同恶性肿瘤的早期诊断。大分子量的全尺寸抗体-颗粒复合物会导致实际到达预期目标位点的纳米气泡数量有限。因此,纳米抗体的使用可以提高纳米气泡的性能,如用填充 C3F8 超声成像气体并携带抗 PSMA 纳米抗体的纳米气泡进行测试,修饰后的纳米气泡能特异性粘附于前列腺癌细胞,并在体内前列腺癌异种移植成像中显示出高度特异性 [14]。
在纳米抗体能够在临床环境中完全实现成像之前,必须解决几个问题,其中之一是由于巨蛋白受体引起的近端小管再吸收,纳米抗体表现出较高的肾潴留。肾脏潴留会导致肾脏损伤,特别是当纳米抗体被放射性同位素标记或配备有细胞毒性药物时。另一方面,肾脏潴留在一些成像应用中也会产生强信号,当身体靠近肾脏时,可能会掩盖与其分子靶标的信号。针对这一问题,科学家们采取了几种解决策略,例如共给凝胶溶蛋白或带正电荷的氨基酸它们与巨蛋白受体相互作用,从而减少肾脏潴留。除此之外,用 PEG 修饰纳米抗体显像剂也可以缓解这一问题[15] 。
4 用于治疗的纳米抗体
4.1 纳米抗体作为免疫检查点阻断疗法
常规检查点阻断疗法使用单克隆抗体与免疫检查点(如 PD-1 或 CTLA-4)结合以提高抗肿瘤免疫应答。与 Fc 融合的抗 PD-L1 纳米抗体 KN035 (KN035-Fc) 在 NOD-SCID 小鼠体内诱导强烈的 T 细胞应答并抑制了 A375-PD-L1 细胞的肿瘤生长。单独使用抗 CTLA-4 纳米抗体 H11 不能控制 GVAX 免疫治疗小鼠的 B16 肿瘤生长,但是当与鼠 Fc 区连接时,H11 比抗小鼠 CTLA-4 单克隆抗体具有更好的总生存率 [16 ]。CD47 是一种被肿瘤利用的抗吞噬配体(“不要吃我”信号)。它通过与吞噬细胞上的信号调节蛋白 α (SIRPα) 结合来减弱抗体介导的吞噬作用。抗 CD47 纳米抗体 A4 单独使用或与肿瘤特异性抗体联合使用均无法产生抗B16 肿瘤的免疫,但是当与 PD-L1 阻断剂联合使用时,CD47 拮抗显著提高了对 B16 肿瘤的应答率[17]。有趣的是,A4 纳米抗体的给药与 PD-L1 有协同作用,但与 CTLA4 阻断没有协同作用[18]。
4.2 纳米抗体-药物偶联物
作为特异性肿瘤靶向疗法家族的一份子, ADC (Antibody-Drug-Conjugates) 兼具小分子药物强大的杀伤力和纯单抗高度的靶向性,它可以借助抗体极高的特异性,将药物精确地投放到肿瘤细胞内,避免对体内正常细胞的杀伤,从而减少治疗过程中的不良反应。在可查的有关ADC 临床试验中,有近 40 项已完成,80 多项正在进行中。HER2、c-MET、CD30 和 PSMA是ADC 的热门靶点。
尽管有证据表明 ADC 的有效性,但在癌症治疗中使用单克隆抗体仍存在缺陷,如,有些肿瘤过大,导致抗体穿透能力有限。因此,较小的抗原结合片段,如 Fab、scFV、minibodies和diabodies,作为 ADC 的平台受到了关注。尽管如此,由于稳定性和亲和力降低或生产困难,这些较小形式的版本通常受到限制。纳米抗体由于循环半衰期更短、组织渗透性更强、稳定性和易于生产,可以克服大部分上述困难。
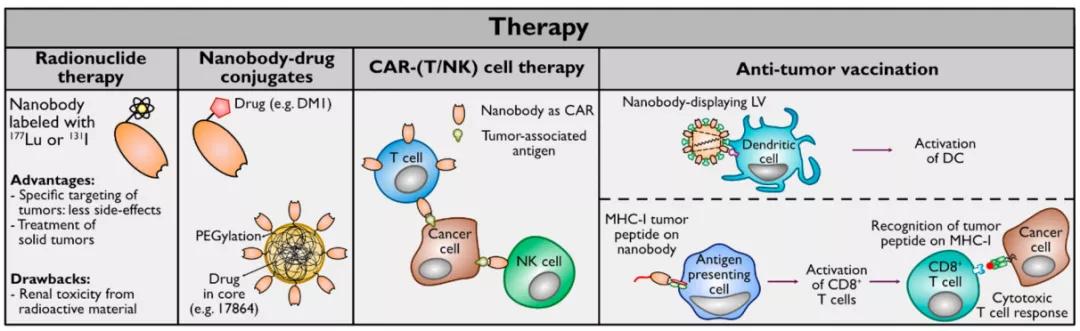
纳米抗体可用于多种肿瘤治疗,如靶向放射性核素疗法、纳米抗体-药物偶联物、过继细胞疗法和疫苗
正在研究的纳米抗体-药物偶联物包括纳米抗体白蛋白纳米颗粒 (NANAP),它的白蛋白核表面修饰有与PEG (EGa1- PEG)结合的egfr靶向纳米颗粒(EGa1- PEG)。NANAP 载有多激酶抑制剂 1786。当在溶酶体中内化消化时,引起激酶抑制剂在细胞内释放,并抑制 EGFR 阳性 14C 鳞状头颈癌细胞的增殖[19]。此外,药物 Mertansine (DM1) 与 MHC-II 靶向纳米抗体 VHH7 的结合,可减少 A20 淋巴瘤移植小鼠的肝转移[20]。在小鼠中,CD11b 在单核细胞、巨噬细胞和粒细胞等多种髓系细胞上表达,而 Ly-6C 在单核细胞上高表达,在粒细胞上低表达,而 Ly-6 G 在粒细胞上表达 ,因此,将抗 CD11b 纳米抗体 DC13 和 Ly-6C/Ly-6G 特异性纳米抗体VHH16 和 VHH21偶联到假单胞菌外毒素 A 上,以在体外和体内消耗骨髓细胞[21]。所有偶联物在体外均表现出细胞毒性。需要指出的是,尽管纳米抗体免疫毒素与每种细胞类型的结合相似,但粒细胞比单核细胞对体内 Ly-6C/Ly6-G 特异性免疫毒素更敏感,这表明需要彻底表征骨髓特异性 ADC 候选物。
4.3 靶向放射性核素疗法 (TRNT)
TRNT 是一种日益流行的抗癌疗法,旨在通过诸如单克隆抗体、抗体片段或其他配备合适放射性同位素的小分子之类的递送载体将细胞毒性辐射传递到癌细胞。靶向递送应限制健康组织暴露在辐射下。典型放射性同位素偶联物替伊莫单抗(Ibritumomab tiuxetan),是一种90Y标记CD20靶向的单克隆抗体,已被获批用于非霍奇金淋巴瘤的放射免疫治疗。类似药物还有 131I-托西莫单抗(131I-tositumomab)。此外,针对 CD33 的特异性抗体和针对CD20 和 CD22 联合靶向抗体的早期临床试验也取得了有希望的结果。然而,靶向大的实体瘤仍然是一个挑战,如 MUC1 和CEA 特异性抗体试验所展示的结果。由于标记抗体进入实体瘤组织的渗透性差,因此更小的标记分子,如多肽和纳米抗体,已被探索作为TRNT的替代品,特别是用于实体肿瘤的治疗。
D'Huyvetter 等人是第一个将纳米抗体用于 TRNT 的人。他们在一项用177Lu-DTPA-2Rs15d纳米抗体处理HER2 + SKOV3异种移植小鼠的研究中证明,与对照组相比,接受治疗的小鼠的肿瘤生长几乎完全停止,无病生存期明显延长,同时未观察到肾脏炎症或坏死的迹象[22]。用 131I 标记的相同纳米抗体已用于乳腺癌患者的 I 期临床试验 (NCT02683083) 。此外,Govindan等发现,用放射性碘化试剂*I-SGMIB标记针对HER2的5F7GGC 纳米抗体,在靶向 HER2+ 癌症方面也显示出有希望的结果[23]。
综上,替伊莫单抗的有希望的结果促使研究人员对 CD20 特异性纳米抗体重复这一策略,这可能会限制 mAb 在非靶向组织中的毒性。用 177Lu 放射性标记的纳米抗体 9079在治疗B16 黑色素瘤的小鼠时,与对照组相比显示出更好的无病存活率。更重要的是,当177Lu-DTPA-sdAb 9079对小鼠的肾毒性很小 [24]。这些临床前研究的结果强调了如何在临床环境中利用纳米抗体的独特特性。但进一步的优化研究以减少肾潴留,进而减少任何可能的不良反应仍是必要的。
4.4 基于纳米抗体的载体递送系统
将纳米抗体修饰到纳米药物载体上(如脂质体、胶束、白蛋白及铁蛋白类的纳米颗粒和聚合物类多聚体等),可以实现基于纳米抗体的抗癌药物向肿瘤组织的主动靶向。将纳米抗体偶联在纳米载体的表面,赋予了这种治疗性纳米颗粒靶向肿瘤的能力,增加了药物在肿瘤中的积累,减少了对正常细胞的损伤。
在14C细胞中,抗EGFR纳米抗体EGa1与聚乙二醇化脂质体结合可在体内外诱导EGFR内化和下调[25]。聚合物聚乙二醇化胶束形成时,观察到类似的受体结合和内化作用,使胶束成为有希望的活性药物靶向系统。为此,研究者将EGa1修饰的胶束与temoporfin (mTHPC)相结合,后者是一种用于头颈部鳞癌(HNSCC)光动力治疗(PDT)的光敏化合物。与游离mTHPC相比,这些胶束在体内的循环时间更长,这表明这些胶束有可能提高PDT在EGFR +肿瘤中的选择性和有效性[26]。细胞外囊泡 (EV) 也被探索为用于治疗目的的纳米颗粒。为了具有肿瘤特异性,此类 EV 必须配备靶向部分。通过糖基磷脂酰肌醇 (GPI) 锚定 EVs 到 EGa1 纳米抗体,工程化的 EVs 显示出在 EGFR 表达细胞中的定位和内化,但临床前使用还需要进一步改善条件 [27]。
4.5 疫苗、慢病毒载体基因治疗和 CAR-T 疗法
预防癌症的疫苗接种将是一种有价值的预防或治疗策略,并将受益于向 APC 特异性递送肿瘤抗原。为此,慢病毒载体 (LV) 被用于将癌症自身免疫抗原递送至 APC。抗体,特别是纳米抗体,可用于将这些 LV 特异性递送至 APC。显示树突状细胞靶向纳米抗体 DC2.1 的 LV 在体外和体内仅转导 DC 和巨噬细胞。人腺病毒5血清型(Ad5)可以有效地转导人细胞,它的趋向性可以通过衣壳修饰而改变,其中包含一个纳米体对抗人CEA (hCEA)。这些表达CEA纳米抗体的Ad5载体成功地转导了表达hCEA的小鼠MC38细胞。同样,纳米抗体也可用于改善腺相关病毒载体的靶向和转导,如靶向抗 CD38 纳米抗体的 AAV1P5 成功转导骨髓瘤细胞的研究所示[28]。
另一种疫苗接种策略侧重于通过抗 CD11b 纳米抗体将癌症抗原靶向递送至 APC 来激活细胞毒性 CD8+ T 细胞。这已经被应用于由致癌 HPV 16 型菌株的 E6 和 E7 基因驱动的 HPV+ 肿瘤。基于与 E7 肽抗原缀合的抗 CD11b 纳米抗体的疫苗在体内诱导了强烈的 CD8+ T 细胞反应,并在体内 C3.43 癌症模型中显示出较慢的肿瘤生长和较长的总生存期 [29]。这些结果突出了纳米抗体在肿瘤免疫策略中的新作用。以类似的方法,通过将位点特异性糖基化 MUC1 肽与II 类 MHC 靶向纳米抗体VHH7结合,可以产生针对肿瘤特异性抗原 MUC1 的强 Th1 免疫反应 [30]。纳米抗体-肽加合物在免疫反应中增加了抗体的产生,这意味着在体内诱导了足够的 CD4 T 辅助应答。
过继免疫细胞疗法 (ACT) 使用患者自身的免疫细胞来靶向癌细胞。T 细胞被设计成表达克隆的 T 细胞受体 (TCR) 或嵌合抗原受体 (CAR)以靶向感兴趣的肿瘤抗原,后者允许识别非 MHC 限制性抗原。一种使用含有抗小鼠 VEGFR2 的 scFv 组成的 CAR 修饰的 T 细胞的 ACT 策略可有效消除小鼠体内几种不同的血管化同源肿瘤 [31]。源自抗体或 scFv 的多种 CAR-T 细胞目前正在临床研究中。一些临床试验显示了针对 CAR-T 细胞的免疫反应,可能是由于对 CAR 构建体中非人类 scFv 成分的免疫原性。这个问题可以会通过使用人源化纳米抗体的 CAR 来解决。Albert等人使用他们的UniCAR 系统,这是一种独特类型的 CAR-T 细胞,可以通过同时注入的目标模块 (TM) 进行重定向,允许在没有目标模块的情况下关闭 UniCAR。用抗 EGFR 纳米抗体修饰的 UniCAR能有效地在体内靶向 A431 细胞 [32],并且当配制为基于二价 α-EGFR-EGFR 纳米抗体的 UniCAR 时显示出更好的抗肿瘤反应 [33];一种VEGFR2 纳米抗体特异性 CAR 在体外显示出有希望的结果,CAR - T 细胞分泌高浓度的 IL-2 和 IFN-ƴ,并且通过LDH释放试验检测到靶细胞上VEGFR2抗原的细胞毒活性[34];同时靶向两种抗原的双特异性 CAR-T细胞可能有效对抗肿瘤细胞中潜在的抗原逃逸。体外实验显示了基于双特异性抗 CD20 和抗 HER2 纳米抗体的 CAR 的巨大潜力,其靶向并杀死表达一种或两种抗原的 Jurkat 细胞 [35];此外,靶向 TME 而非直接靶向肿瘤可能有利于靶向多种肿瘤类型。在 B16 和 MC38 模型中,抗 PD-L1纳米抗体的 CAR-T 细胞可以减缓肿瘤的生长速度;基于纳米抗体的靶向纤连蛋白剪接变体 EIIIB-CAR-T 细胞,在体内显著减缓了 B16 黑色素瘤的生长 [36];而在同时分泌抗PD-L1 或 CTLA4 纳米抗体的细胞中,EIIIB 纳米抗体 CAR-T 细胞的抗肿瘤功效得到了提高,CAR T 细胞分泌 CD47 纳米抗体降低了全身细胞毒性[37]。值得一提的是,由于EIIIB 剪接变体的序列在小鼠和人中是相同的,因此在临床应用这种纳米体作为识别模块的人CAR - T细胞可能是有前途的。
上述这些例子主要侧重于改造患者的自体 T 细胞。然而,对于 T 细胞特异性癌症(如 T-ALL)患者来说,选择非恶性 T 细胞是很困难的。为了克服这个问题,可以使用 CAR-NK 细胞。NK 细胞上的基于抗 CD7 纳米抗体的 CAR 在 PDX 小鼠模型中显示出对肿瘤细胞的抑制作用 [38]。基于双特异性抗 CD38 纳米抗体的 CAR-NK 细胞在体外有效消耗来自患者多发性骨髓瘤骨髓细胞的 CD38+ 细胞 [39]。基于纳米抗体的 CAR-T 细胞疗法目前正在进行临床试验,用于CD19/CD20双特异性靶向治疗B细胞淋巴瘤(NCT03881761)和BCMA靶向治疗多发性骨髓瘤(NCT03664661)。
5 总结
总的来说,这些研究阐明了纳米抗体在癌症诊断和治疗中的重要作用。它们的生物物理特性从根本上不同于传统的双链结构。纳米抗体的小尺寸、抗原特异性、结合亲和力和稳定性使其能够成功地靶向肿瘤、肿瘤微环境和在那里募集的免疫细胞中的抗原。纳米抗体越来越多地被用作分子成像技术(如 PET、SPECT 和 NIR 荧光成像)的诊断工具,成功的早期临床试验也证明了这一点。作为治疗剂,纳米抗体可以帮助递送药物或放射性同位素,并可用于肿瘤疫苗接种策略和 CAR-T 细胞治疗。纳米抗体的全部可能应用还有待探索,但作为传统免疫球蛋白的补充或替代品:纳米抗体将持续在领域内发光发热。
- 上一篇: 一文看尽纳米抗体在肿瘤领域中的应用(上)——靶点汇总
- 下一篇: 纳米抗体结构特点及其抗原结合活性研究

