Blood:纳米抗体联合CAR-T疗法,可根除AML
1989年,比利时布鲁塞尔自由大学(Free University of Brussels)的两名学生在检测来自骆驼的冷冻血清时偶然发现了一种此前不为人知的抗体。这是一种人类抗体的小型化版本,只由两条重链组成,而非两条重链和两条轻链组成。此后,这类抗体的存在相继又在羊驼和美洲驼中得到证实。
从发现至今,经过30多年的发展,纳米抗体已经运用于对抗毒感染、细菌感染以及神经退行性疾病等的研究。
此外,随着细胞治疗领域(CAR-T疗法)的快速发展,纳米抗体也广泛应用于细胞治疗领域的抗体筛选,甚至在不需要人源化的过程下直接进行构建,大大加强了开发效率。
近期,研究人员开发了一种序列肿瘤选择性抗体和抗原检索(STAR)系统,以快速分离多个纳米抗体(Nanobody,Nb),这些纳米抗体既能优先结合急性髓系白血病(AML)细胞,又能增强CAR-T细胞的抗AML效益。STAR-分离的Nb157,特异性结合CD13,在AML细胞中高表达,CD13 CAR-T细胞可有效清除体内外的AML。
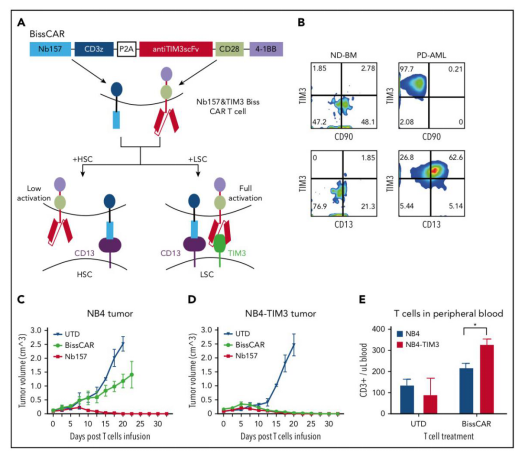
TIM3是一种免疫抑制受体,在大多数人AML白血病干细胞(LSC)中高度表达,而在HSC中却不是。在临床前模型中,靶向CD13(STAR分离的)和MIT3的CAR-T细胞可以根除人源异种移植物(PDXs)中的AML,且对人类HSC的毒性大大降低。
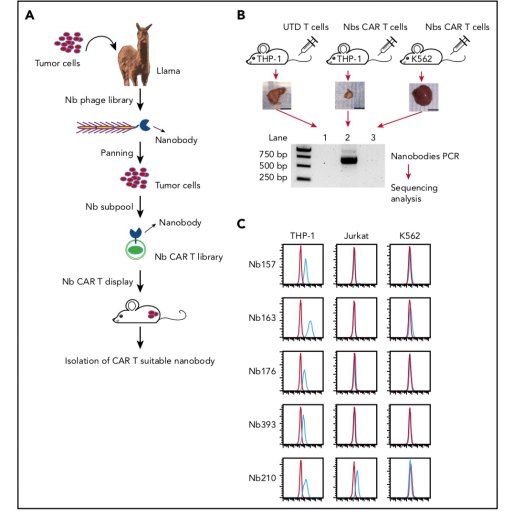
纳米抗体噬菌体库构建和动物实验
本次实验中,研究者每月一次用2x107THP-1细胞免疫美洲驼,持续3个月。然后进行外周血单核细胞分离,RNA提取和cDNA合成。
小鼠经30mg/kg Busulfex处理24小时后,尾注射2x107个患者来源的AML细胞。两周后,将CAR或未转导(UTD)T细胞施用于小鼠。根据方案在实验终点对安乐死的小鼠实施安乐死,并收集股骨,脾脏和肝脏,通过苏木精和伊红染色进行组织学分析。
为了鉴定与CAR相容的Nb,研究者将Nbs从噬菌体库克隆到CAR构建体中,通过慢病毒转导产生Nb CAR T细胞,然后在体内进行CAR T细胞治疗(下图B)。T细胞输注后14天,收集所有肿瘤组织,并从肿瘤浸润的Nb-CAR T细胞中解析Nb序列。PCR结果表明,Nb序列特异性地来源于Nb - sub-lib CAR t -cell处理过的THP-1肿瘤(图B, lane 2),而不来源于K562或UTD处理过的THP-1肿瘤。在5种最富集的Nbs中,Nb157Nb157,Nb163,Nb176和Nb393特异性结合THP-1细胞,但不结合Jurkat或K562细胞(图C)。此外,Nb157和Nb163也结合其他AML细胞系,例如HL60,NB4和U937。总之,这些结果表明,STAR系统能够富集和分离特异性结合AML细胞的多个Nbs。
体外研究结果
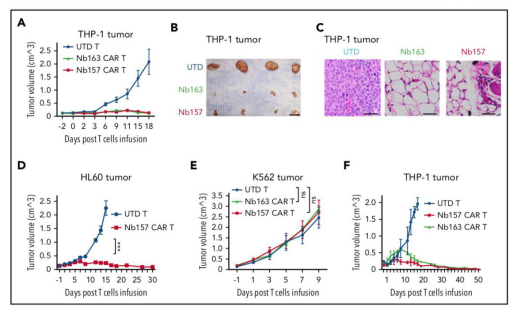
为了确定STAR分离的Nb是否可以引导CAR-T细胞靶向杀死肿瘤细胞,研究者将这些Nb CAR转导到活化的原代人T细胞中(下图A)。在细胞毒性试验中,UTD T细胞未引起明显的细胞毒性(下图B-D);而Nb157 CAR-T细胞能有效杀死THP-1细胞,但不能杀死K562或Jurkat细胞(下图B、D)。同样,Nb163、Nb176和Nb393 CAR-T细胞也特异性杀死THP-1细胞(下图C)。
此外研究者还发现,THP-1细胞,而不是K562细胞,能够特异性刺激Nb157和Nb163 CAR-T细胞释放细胞因子,包括TNF-α和IFN-γ(下图E-F)。另一方面,THP-1细胞特异性诱导CAR-T细胞脱颗粒,这一点体现于细胞表面CD107a的增加(下图G),而且还特异性诱导Nb157和Nb163CAR-T细胞增殖(下图H-K)。这些发现表明,Nb157和Nb163 CAR-T细胞被AML细胞特异性激活、增殖、释放细胞因子并脱颗粒以杀死AML细胞。

体内研究结果
为了确定Nb
CAR-T细胞是否在体内抑制AML,研究者将THP-1细胞移植到NSG小鼠皮下,然后用Nb157 CAR-T细胞、Nb163
CAR-T细胞或UTD T细胞进行处理。注射UTD T细胞的小鼠其肿瘤呈指数增长;但是注射Nb157或Nb163
CAR-T细胞小鼠的肿瘤无法充分生长,最终消退(下图A-B)。组织学研究表明,UTD T细胞治疗组中的肿瘤包含大量的肿瘤细胞,但是Nb CAR-T细胞根除了癌细胞,并在肿瘤部位留下了纤维化组织(下图C)。相关具体结果如下图。
研究者开发了结合双特异性和split CAR的(BissCAR)T细胞系统,可有效杀死CD13+ TIM3+LSC,同时降低对仅表达CD13的正常细胞的影响(下图A)。靶向CD13和TIM3的Biss CAR-T细胞能够根除体内的AML异种移植物和AML患者来源移植物,具体结果如下图。
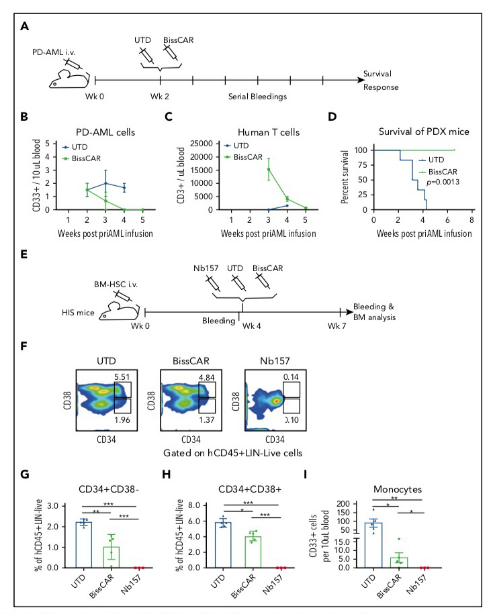
靶向CD13和TIM3 Biss CAR-T细胞在体内对HSC的毒性有所减低,具体结果如下图。
结论
这项研究建立了一个技术平台——STAR系统,该系统能同时分离出多种肿瘤选择性且与CAR相容的纳米抗体。靶向CD13和TIM3的BissCAR-T细胞可根除患者来源的AML细胞,而且对人骨髓干细胞和小鼠模型的外周髓系细胞的毒性大大减弱,可能是开发有效的AML CAR-T细胞疗法的一种有前途的方法。该研究加速了CAR-T细胞介导的免疫疗法的发展。
- 上一篇: 单克隆抗体的作用机制及其体外功能验证
- 下一篇: CAR-T生产过程的质量控制

