菜鸟入门,如何纯化抗体
抗体作为生物学上的一个有用工具已经超过一个世纪。19世纪70年代,抗体在研究和商业应用方面的使用取得了前所未有的进展。抗体最初是作为治疗病毒性疾病的天然抗血清来使用的。现今,高度工程化的治疗性抗体已被用于治疗多种危及生命的疾病。在这里我们将介绍纯化抗体的几种方法,尤其是单克隆抗体体的纯化。本文所介绍的方法是专为中小规模的抗体纯化总结,这些方法可通过手动执行或半自动仪器设备来完成。一种方法不可能适用于所有抗体,且任何一种抗体都可通过多种不同的操作方法进行纯化。
大多数实验室应该考虑选择一个纯化平台,每种方法都可以提供一个理想的结果。此外,还有不需要纯化的情况存在,如进行一项免疫电泳或者放射免疫扩散实验。在这些情况下只要包含合适的对照组,抗体的粗提物就能很好地工作。但是,对于临床前期试验中所使用的抗体,必须采用先进的多步的纯化程序来获得高度纯化的抗体。纯化步骤越多越复杂,纯化实验室越需要高效和经济。
一、通过沉淀进行部分纯化
用硫酸铵沉淀蛋白质是抗体部分纯化中最古老的方法之一,将饱和硫酸铵加入血清或者腹水中来沉淀抗体,通过离心分离沉淀与未沉淀的蛋白质。当用水溶剂将沉淀重悬后,所得的溶液即为富含抗体的液体;相比之下,使用辛酸沉淀,大多数沉淀的蛋白质不是免疫球蛋白。此操作结束后,抗体存在于上清中。
1、硫酸铵沉淀。
(1)准备一份饱和硫酸铵(AS)溶液(4.lmol/L)(向血清或者腹水中加人等量的饱和AS溶液,此时溶液的饱和度达到50%,抗体将会被沉淀。
(2)沉淀前,2500r/min离心腹水或血清15~30min,使原液澄清,将血清或腹水转入一个清洁的烧杯中,放入一个磁力搅拌子,将其放置在磁力搅拌器上搅拌。
(3)加入与原液等体积的饱和AS溶液。缓慢加人硫酸铵使其与腹水或血清混合。等出现的沉淀溶解后再加人更多的AS。当已经要基本加完所有的AS时将会出现不溶解性沉淀。继续加完所有的AS。让溶液在4℃继续混合6~24h。
(4)沉淀完成后,3000g离心溶液30min,弃上清(保留弃液样品作为后期的检测)。缓慢加入150mmo1/L PBS溶液于沉淀中,用移液枪轻柔搅拌混匀。加人足够的PBS,其体积相当于原液的25%~50%。
(5)将溶解的预处理抗体用20倍体积的PBS溶液透析。由于AS的高盐浓度,建议至少每2h更换~次透析缓冲液,更换3次。
(6)对终产物进行蛋白质浓度测定、区带电泳、密度扫描以及特异性检测。这些检测结果将显示抗休的纯化水平及活性。
(7)纯化抗体应该小份量分装并一70℃保存。
2、辛酸沉淀
(1)称量并记录腹水或血清的体积,将其转移到一个清洁的烧杯或烧瓶中。加入磁力搅拌子并放置在磁力搅拌器上搅拌。
(2)加入2倍体积的pH4.0,60mmol/L的乙酸缓冲液,调节pH至4.8。
(3)缓慢地将辛酸(辛酸原液)滴加入腹水或血清并轻轻搅拌溶液。10ml稀释后的腹水或血清中加人0.4ml的辛酸。室温下,搅拌30min。
(4)5000g离心10min。取出上清并保留。
(5)如前所述,富含抗体的上清在保存前应该对20倍体积的PBS溶液进行透析。
这些方法获得的产量不超过5O%,纯度通常也不超过70%。因为这些方法无法产生高纯度的初制抗体,还需要进一步的纯化。策略之一是对腹水进行二次沉淀以产生中等纯度的抗体纯化物。可先进行硫酸铵沉淀,再进行辛酸沉淀。硫酸铵沉淀后,抗体初提物在PBS溶液中复性,然后在60mmol/L的乙酸盐缓冲液中透析。透析后,在进行辛酸沉淀前应将pH调至4.8。无论是通过硫酸铵沉淀,或者辛酸沉淀,或者通过两者,所得抗体都是有用的。用沉淀方法纯化的抗体能被成功应用于实验操作,如酶免疫试验、免疫沉淀、免疫印迹及斑点杂交。
经过硫酸铵或者辛酸沉淀的抗体纯度可通过区带电泳凝胶来检测(图1)。通过此分析,可以通过硫酸铵(泳道1)、辛酸,以及二者的联合沉淀步骤(泳道3)从腹水中纯化出单克隆抗体。单克隆抗体的浓度经AS沉淀后由原液的16.3%增加至23.0%,经二步沉淀后浓度增至32.75%。单独应用AS沉淀提高了单克隆抗体的浓度,但联合沉淀操作使得抗体的纯度得到了更喜人的提高。尽管如此,即使应用二步沉淀,抗体的纯度也还是只能达到75%~80%。
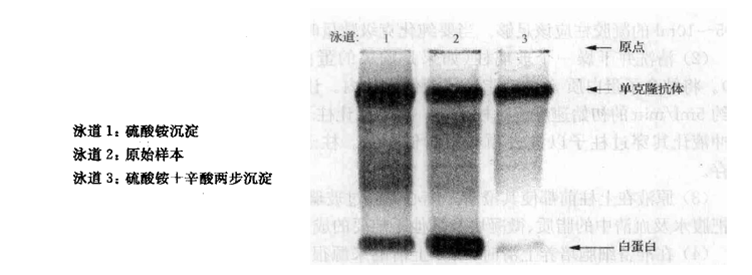
图1:区带电泳凝胶显示的是一种血清样本(S)经过单独的硫酸铵沉淀(A)或者经过硫酸铵及辛酸两步沉淀(A+C)的电泳效果图。
二、蛋白质A和蛋白质G
一般来说,蛋白质A和蛋白质G为从血清、腹水、细胞培养上清中纯化单克隆抗体提供了最好的方法。纯化后的终产品纯度最低可达95%,可用于各种实验和操作。用蛋白质A或蛋白质G进一步处理纯化的单克隆抗体,可用来进行临床前期或临床试验。现在也有许多纯化仪器使这些操作自动化。
1、蛋白质A
蛋白质A是细菌细胞壁的一个构成组分,对Fc区域有高度结合亲和性,蛋白质A可以从商业途获得,可以是单纯的形式或者螯合到树脂上。凭借结合和洗脱条件,蛋白质A能够依据亚型来纯化单克隆抗体。例如,小鼠的腹水含有自身免疫球蛋白(一般为IgG1和IgM)和杂交瘤分泌的单克隆抗体。蛋白质A在低盐条件下不结合IgM。与IgĢ1有微弱的结合。因此,如果单克隆抗体的亚型是IgG2a,IgG2b或者IgG3,那么便可获得相对纯净的这些单克隆抗体。在高盐(约3mol/L)结合缓冲液的条件下,蛋白质A可成功用于纯化IgG1。在这种条件下,当用腹水作为来源材料时将会有一些自身免疫球蛋白。如果必须去除这些自身免疫球蛋白,那么应该用细胞培养进行制备单克隆抗体。
1.1试剂
10XPBS:1.5mol/L PBS,pH7.6
Nacl(固体)
结合缓冲液:3.0mol/L的Nacl,100mmol/L柠檬酸/磷酸盐缓冲液中,pH9.0
洗脱缓冲液:100mmol/L柠檬酸/磷酸盐缓冲液,PH 3.0
平衡缓冲液:1.0mol/L Tris
透析缓冲液:150mmol/L PBS;pH 7.6
A.操作步骤
(1)根据将要纯化的抗体数量来决定预装柱的大小。蛋白质A的结合能力是每毫升树脂可结合5~20mg的免疫球蛋白。因此,如果要纯化10~100mg的蛋白质,那么5-10ml的凝胶柱应该足够。当要纯化克级数量时最好用50-100ml的凝胶。
(2)清洗并干燥一个玻璃柱(如果是购买的蛋白质A-琼脂糖预装柱,则可忽略此步)。将结合了蛋白质A的琼脂糖浆液导入柱内。让凝胶颗粒自然下降,使结合缓冲液以5ml/min的初始速度流过柱子,一定不要让柱子流干。加入3-5个体积的结合缓冲让其穿过柱子以洗去颗粒中的储存液。柱子清洗完成后可立即使用或者于4摄氏度保存。
(3)原液在上柱前都使其澄清。离心并经过玻璃纤维滤器过滤会把腹水及血清中的脂质、微凝块及其他不想要的成分除掉。
(4)在准备细胞培养上清时,培养上清的来源很重要。来自传统培养装置的上清,应浓缩10倍。而来自于高级培养系统的培养上清,如中空纤维及搅拌生物反应器,除非体积很大,否则不需要浓缩。在上述两种情况下,培养基在收获和浓缩后,一定要经过离心和过滤使其清亮。
(5)腹水、血清或者培养上清被澄清后,9ml原液要加1ml 10×PBS溶液。确定原液的最终体积并根据这个公式加入NaCl:原液体积(ml)X0.1753=要加入的NaCl克数。加入盐并搅拌至其溶解。
(6)在加原液前,柱子要从储存处拿出使其温度平衡到室温,并用结合缓冲液冲洗。建议用紫外检测仪监测流出物,这样蛋白质从柱子中流过和流出时便可以观察和记录到。当结合缓冲液到达基线并平稳时,就可以上样了。
(7)加人柱子中的抗体上样原液量与柱的大小及每毫升原液中所含抗体的估计数量有关。大多数蛋白质A的抗体结合能力至少为4~5mg抗体/ml凝胶。因此,如果是10ml的柱子,加人的抗体量应少于40~50mg。通常情况下,血清中抗体的含量是5~10mg/ml,腹水中抗体的含量为3~12mg/ml,细胞培养上清如果被浓缩,其抗体含量将为0.2-2mg/ml。
(8)当结合缓冲液的液面与柱床表面相平时,向柱内缓慢添加抗体上样原液。让原液充分流人柱床。当所有原液进人柱床后,再用几毫升结合缓冲液淋洗柱壁。让此液也进人柱内。然后添加结合缓冲液让原液继续流过柱床。继续添加结合缓冲液,与此同时用280nm(A280)的吸光值来监测流出柱子的蛋白质。
(9)准备好一个干净的玻璃容器。向容器中加人1mol/L Tris,其量为抗体洗脱液体积的1/10。例如,如果抗体洗脱液为10ml,郡么就向容器中加入1ml的1mol/L Tris溶液。
(10)当280nm(A280)的吸光值回到基线时,加洗脱缓冲液。当吸光曲线表明纯化抗体开始流出柱子时,将装有Tris的容器放在柱子的下面来收集纯化的抗体。当记录曲线返回接近于基线并达到平稳时,对抗体的洗脱完成。一般情况下,因为洗脱缓冲液和结合缓冲液的盐浓度不同,在280nm的吸光值也有些许的不同而导致记录曲线不再返回初始基线,抗体洗脱完成后会出现一个新的基线。
(11)所有抗体收集完毕后,加结合缓冲液。用至少两个柱体积的结合缓冲液清洗柱床或者直到280nm(A280)的吸光值记录曲线返回初始基线。
(12)这时,柱子便可用于抗体原液的重复上样(为检测样本是否过量上样,可将前面的从柱中用结合液洗脱的A280所测的第一个宽峰的废液重新上样)。抗体原液可重复上样直到全部收获。洗脱下来的抗体可保存于4℃,每次收获的抗体可加在一起直到整个纯化完成。最好检测一下所收获的抗体的pH,确保其为7.2~7.6。
(13)从抗体原液中纯化抗体全部完成后,应采用PBS溶液对纯化的抗体进行透析。透析后抗体有可能需进行浓缩,因为透析可能导致抗体被稀释。大多数抗体的浓度可被安全的浓缩到1-10mg/ml。单克隆抗体在浓缩的过程中有可能出现沉淀。如果担心损失抗体,可将其只浓缩到2~5mg/ml。
(14)需要注意IgG1抗体在如此低的pH(pH 3.0)条件下的洗脱。IgG1在pH 6.0时即可被洗脱下来,这点在计划纯化策略时值得考虑。如果单克隆抗体在极低pH条件下不稳定,那么使用pH为4.5~6.0的洗脱液可能对抗体的稳定性很重要。此外,还可考虑梯度pH洗脱的方法,可使柠檬酸/磷酸盐缓冲液的浓度保持不变而逐渐降低pH。这种方法可使抗体得到在最适pH时的洗脱。
(15)此方案适用于小鼠抗体的所有亚型。但是,温和一些的纯化条件可用于IgG2a、IgG2b或者IgG3亚型的纯化。用低盐结合缓冲液(缓冲液中含0.5mol/L NaCļ)替代高盐结合缓冲液(如柠檬酸/磷酸盐缓冲液中含3mo1/L Nac1),使用下面的公式计算:
NaCl的量来固定原液中的抗体于柱上:原液的体积(ml)X 0.0292=要加入的NaCl克数,调节pH至9.0。这种改变将有助于降低腹水中的宿主自身IgG1被同时纯化。由于这些亚型与蛋白A结合的十分牢固,所以它们必须在pH为3.0~4.5时被洗脱下来。在任何情况下,确保用Tris来中和洗脱下来的抗体,以阻止其变性或降解。
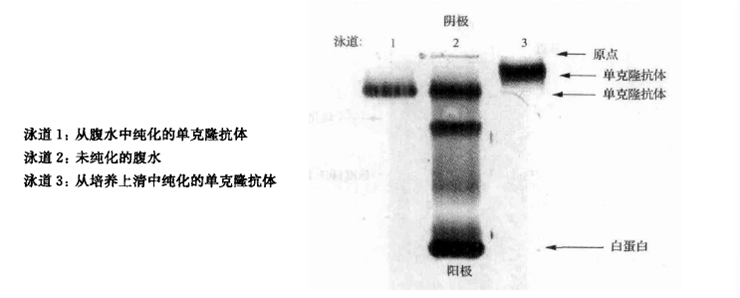
图2:区带电泳凝胶显示腹水中的(泳道2)经蛋白质A纯化后的纯度提高(泳道1)。
2、蛋白质G
蛋白质G是构成细菌细胞壁的另一种蛋白质,对免疫球蛋白的Fc区域具有高度的亲和性。蛋白质G结合人和除了兔以外的动物血清中的抗体效果最好,尽管也可用其来纯化鼠的单克隆抗体,但是蛋白质A纯化小鼠的和兔的抗体更好。
2.1试剂
10×乙酸钠缓冲液:1.0mol/L乙酸钠;pH5.0
结合缓冲液:100mmol/L乙酸盐缓冲液,pH5.0
洗脱缓冲液:100mmol/L甘氨酸,pH 2.5
平衡缓冲液:1.0mol/LTris
透析缓冲液:150mmol/L PBS,pH 7.6
A.操作步骤
蛋白质G的使用与蛋白质A类似。蛋白质G被交联到树脂上,可以预装柱或者匀浆的形式购买。抗体上样原液的准备与上面提到的蛋白质A纯化需考虑的因素相同。因此,上面蛋白质A的步骤(1)~(4)亦可应用于此且不再重申。此实验方案从抗体上样原液的准备开始。
(1)使用一些方法使抗体上祥原液清亮。9ml的抗体上样原液加1ml10×乙酸钠缓冲液调节pH至5.0.
(2)将抗体原液加到蛋白G柱上,使其流入基质。然后立即添加结合缓冲液保持液体流。当所有的未结合物被洗出柱床,监测器返回基线时,加入洗脱缓冲液。
(3)将洗脱的抗体收集到一个含1mol/LTris缓冲液的烧杯中,收获的抗体将会被Tris缓冲液稀释10倍。
(4)与之前所介绍的蛋白质A纯化相同,柱子可重复上全部抗原液被纯化,将收获的洗脱抗体在PBS溶液中进行透析。
B.纯化柱的再生和复性
蛋白质A和蛋白质G凝胶柱可重复使用。但是,重复使用这两种基质需要注意的几点。最好是一个柱子用来纯化一种抗体,但是对于每个实验室来说这未必可行。如果一个柱子要用来纯化不同抗体,那么柱子应该再生。纯化柱再生的方法可从制造商处得到,但一般而言,蛋白质A可用2mol/L尿素、1mol/L LiCl或者100mmol/L甘氨酸再生。如果适当,可用100mmol/L NaOH对柱子除热原。通常应该用至少两个柱床体积的这些溶液来洗柱子。每次再生后,要用PBS溶液洗柱子以清除这些溶液。柱子应该置4摄氏度保存,可加或不加叠氮钠。
对于蛋白质G,用100mmol/L PH 2.5的甘氨酸来再生柱子。与蛋白质一样,柱子应置4℃保存,可加或不加叠氮钠。
3、IgG抗体的其他纯化方法
抗体纯化还有其他方法。最著名的是分子筛层析法(SEC)及离子交换层析法(IEC)。对于IEC,有许多阴离子交换树脂,它们作用于单克隆抗体的效果要好于多克隆抗体,因为想要纯化出最高产量的抗体就需要知道抗体的等电点。很明显,多克隆抗体的等电点范围宽,而单克隆抗体的等电点范围较窄。下面的图表显示了各种单克隆抗体亚型在使用阳离子或者阴离子交换柱纯化时,其洗脱峰时的NaCl摩尔浓度范围(图4)。
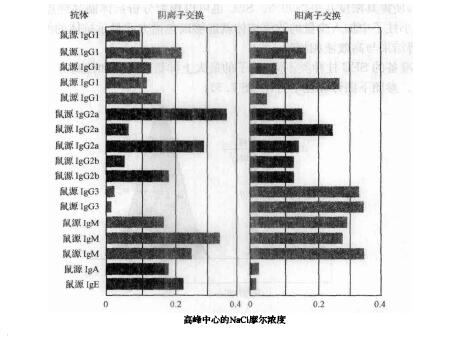
图4:17种单克隆抗体在阴离子和阳离子交换层析时的洗脱特点。阴离子交换是在pH 8.6的50mmol/L Tris缓冲液下进行的。阳离子交换是在pH 5.6的50mmol/LMES缓冲液下进行的。
由于多克隆抗体等电点范围较宽,所以用某一特定的pH缓冲液及离子强度洗脱时,不是血清中的所有抗体都能与基质保持结合。因此,最好采用梯度洗脱体系。可对血清中洗脱的免疫球蛋白进行选择,并可将不同条件洗脱的抗体加到一起。对于某些多克隆抗体,其他血清蛋白可能在相同的条件下与其一同洗脱。IEC要优点是成本低。不论是阳离子还是阴离子交换树脂其费用均比蛋白质A和蛋白质G低。但与蛋白质A和蛋白质G相比,这种方法纯化结果变异很大参并且纯化条件需依据每种抗体而确定。纯度范围为60%~95%。
IEC的最大的优点是它能精制备其他方法纯化的单克隆抗体。IEC将分离去除单克隆抗体中的蛋白质A或蛋白质G、DNA、逆转录病毒及内毒素。所得的单克隆抗体纯度可被认为〉99%,这对制备用于动物实验和临床试验的单克隆抗体具有很大价值。
SEC是蛋良质纯化中最古老的技术之一,同时也是一种温和的方法,因为可用生理条件下的缓冲液将抗体在最适pH中进行纯化。一些制造商生产多种树脂。对于抗体,葡聚糖凝胶是常用的树脂。数值体现在颗粒的孔径度上,数值越高,表明孔径越大。大分子不进人胶孔内先流出,因此它穿过柱子的速度要比小分子快。小分子在流经孔径时因被阻止而进入基质所以比大分子后洗脱下来。
经过蛋白质A/G纯化后,可能会有一些脱落的蛋白质A/G、细胞来源的DNA、小的抗体片段及大的蛋白质聚集体。在蛋白质A/G纯化后,可用SEC去除抗体制品中的这些少量成分,使得其浓度几乎〉99%。SEC也可以作为分析抗体制品纯度的一种廉价手段。在一个小柱子中加人少量的浓缩抗体就能够以色谱方式显示抗体的纯度和杂质的分子大小,所得结果与高效液相相近。
依据所准备的SEC柱种类不同,柱子的最大上样量与柱宽和柱高有一个最低限度的绝对相关性。参照下图计算柱子直径(图5)
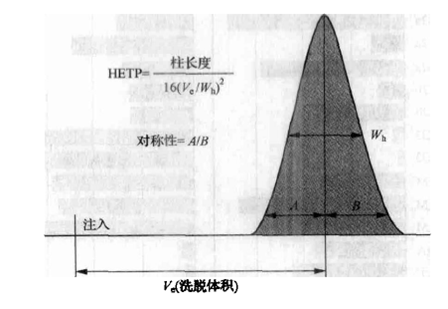
图5:凝胶过滤柱的高度和宽度与柱的最大上样量之间的关系。柱高所定的理论上样量(HRTP)。Wb指在一半高度时的峰宽,A和B是峰高10%时的宽度涮量值。
除非柱子的直径达2英尺以上并且柱高达几英尺,否则不能以大样本上样。依相关经验,上柱的抗体体积为整个柱容量的5%。在大多数情况下,一次只能纯化几毫克的量。因此大量抗体的纯化是一个冗长复杂的过程。尽管如此,SEC仍是増加抗体产品纯度的有价值的方法,并且也是分析最终的抗体纯度的廉价途径。
三、IgM和FAB抗体片段的纯化
IgM抗体以难于纯化著称,因为它是以五聚体结构存在。要纯化IgM,需要结合盐析及IEC或者SEC的多步操作,这是纯化IgM的令人满意的手段,但是对于大量的抗体,这种方案过于繁琐且预期的产量低。因此可以使用蛋白质L亲和层析和山羊抗鼠IgM抗体亲和层析。
1、抗鼠IgM抗体亲和层析
纯化lgM的首选技术是用山羊抗鼠IgM亲和层析柱。可通过购买已经交联抗体的琼脂糖树脂并自己装柱。
1.1试剂
结合缓冲液:10mmo1/L磷酸缓冲液含0.5mol/L NaCl,pH 7.2
2X结合缓冲液:20mmo1/L磷酸缓冲液含1mol/L NaCl,pH 7.2
洗脱缓冲液:100mmol/L甘氨酸含150mmol/L NaCl,pH 2.4
平衡缓冲液1.0mol/LTris
透析缓冲液150mmo1/L PBS溶液,pH 7.6
柱子的准备可按照准备蛋白质A/G柱的程序。向干净的玻璃柱内倒入交联山羊抗一鼠IgM的琼脂糖树脂。当微珠沉淀后用结合缓冲液冲洗,用几个柱容的结合缓冲液清洗匀浆。当A280监测器显示洗脱液吸光值达水平基线时,柱子便可随时使用。尽管任何来源的鼠IgM都可上柱,我们认为培养上清要好于腹水。当用腹水作为原材料时,可见到纯化的IgM有少量的白蛋白污染。如果没有选择,那么可能有必要用IEC或者SEC进行进一步纯化。'
操作步骤
(1)用2×结合缓冲液1:1稀释澄清的抗体原液。只需准备当天要纯化的样本量。剩下的原液何时纯化何时稀释。
(2)第一次上样时,建议加过量的抗体原液。保留从柱中流出的废液,因为其中含有抗体。这种作法的目的是确定层析柱对所需纯化IgM的最大结合量。
(3)上样品后,收集并保留柱中流出的原液及第一次洗柱的液体。用结合缓冲液洗柱直到监测器返回基线为止。
(4)用洗脱缓冲液洗脱结合的抗体。将紫外分光光度计设置0D=280nm,在此波长处测定洗脱下来的抗体量。参考此浓度值,便可知道制所备的亲和柱的抗体结合量,以进行剩余的抗体纯化。
(5)根据对原液中所含抗体量的估计,依照先前的分离程序,将所有或者一部分搜集的流出液重新上柱。
(6)用结合缓冲液洗去未结合的物质。当监测器返回基线时,直接洗脱抗体于Tris中和缓冲液中。
(7)当所有抗体洗脱完毕、监测器回复到基线,加结合缓冲液于柱内。当监测器达到基线时,柱子巳准备好加入下一步的抗体原液。
(8)将洗脱下来并已中和过的抗体保存于4℃以便与再次纯化的IgM合并。
(9)继续上样并洗脱结合的抗体直到将所有抗体纯化完。
(10)集中所有洗脱抗体并对PBS溶液透析。抗体可进一步浓缩但IgM有易沉淀析出的倾向。建议以2~5mg/ml的浓度保存最终的抗体。
用山羊抗鼠IgM亲和层析柱进行纯化的IgM抗体可用凝胶电泳来检测。在区带凝胶电泳上呈弥漫带型是大多数IgM单克隆抗体的典型特征。IgM是一个大分子,分子质量约750kDa,有大量的糖基化位点。拥有这些位点,一种lgM会有相当宽的电荷范围。从培养上清中纯化的lgM抗体将不含腹水中白蛋白的污染(图6)。
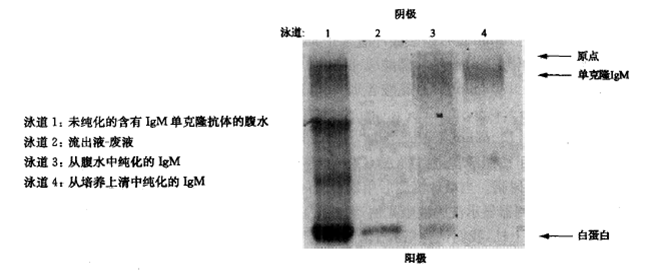
图6:经山羊抗鼠lgM亲和柱纯化的lgM的纯度可用凝胶电泳(PAGE或者IEF)来检测。在区带凝胶电泳上呈现弥漫带型是大多数lgM单克隆抗体的典型特征。IgM是一个大分子,分子质量约为750kDe,有大量的糖基化位点。拥有这些位点,一种IgM就带有相当宽的电荷范围。从培养上清中纯化的IgM抗体将不含腹水中鼠白蛋白的污染
2、蛋白质L亲和层析
蛋白质L对抗体轻链具有高亲和力,可纯化完整抗体和抗体的片段。因此,可用其对IgM和Fab片段进行纯化。但因其半衰期短,所以纯化的结果不稳定,蛋白质L是一种替代型“广谱”抗体纯化基质。蛋白质L与免疫球蛋白的k轻链结合,这对于纯化抗体片段及完整的IgG、IgM和IgA很有用。
2.1试剂
结合缓冲液:10mmo1/L PBS,pH 7.4
2×结合缓冲液:20mmol/L PBS,pH 7.4
洗脱缓冲液:100mmol/L柠檬酸缓冲液,pH 3.0
中和缓冲液:1.0mol/L Tris
透析缓冲液:150mmol/L PBS,pH 7.6
2.2 操作步骤
(1)用2×结合缓冲液1:1稀释澄清的抗体上样原液。只需准备当天要纯化的样本量。剩下的抗体上样原液何时纯化再何时稀释。
(2)抗体上样原液第一次上样时,建议过量上样。保留流出液因为其中将仍有抗体。这种做法的目的是确定所准备的柱子对准备纯化的完整抗体或者抗体片段的最大结合量。
(3)加样后,收集并保留抗体上样原液流出液及第一次洗柱的液体。用结合缓冲液洗柱直到监测器返回基线为止。
(4)用洗脱缓冲液洗脱结合的抗体。将紫外分光光度计设置0D=280nm,在此波长处测定洗脱下来的抗体量,依据此数据,便可知道层析柱的抗体结合量,以进行剩余的抗体纯化。
(5)完成先前所述纯化程序后,依据抗体上样原液的中抗体含量的估算,将所有或者一部分流出液返回此柱。
(6)用结合缓冲液洗去未结合的物质。当监测器返回基线时,直接洗脱抗体于Tris中和缓冲液中
(7)当所有抗体已洗脱完、监测器已经平稳后,加结合缓冲液于柱内。当监测器达到基线时,柱子可用于重新上样。
(8)将洗脱下来并已中和过的抗体保存于4摄氏度,以便与再次纯化的抗体合并。
(9)继续上样并洗脱结合的抗体直到将所有抗体纯化完。
(10)集中所有洗脱抗体并对PBS溶液透析。可进一步浓缩抗体到终浓度2~10mg/L
蛋白质A.蛋白质G及IEC对于上述纯化程序最具有大量纯化抗体的能力。可制备大柱子:购买的纯化材料越多,那么每单位的材料就越便宜。用这三种基质装柱,纯化柱的大小基本上没有限制。许多商品柱可容纳数升至数千升的纯化产物。在实验室或者抗体纯化中心,SEC纯化柱的高度只有房闻天花板能限制。诚然,非常大的柱子能处理大体积的抗体上样原液,尽管纯化柱的制备中的问题可能会降低柱子。
(本文摘录于《抗体制备与使用实验指南》作者G.C.霍华德,翻译张权庚,)
- 上一篇: 抗体制备指南——免疫方案的选择
- 下一篇: 常见抗体药物研发策略

