双特异性抗体双靶向的特点使其具有巨大的治疗前景。近日,来自莫纳什大学等机构的研究人员详细介绍了一种双特异性纳米抗体,可以通过稳定持久的方式靶向CD1d分子与自然杀伤性T 细胞(NKT)之间的相互作用来对抗多发性骨髓瘤和急性髓性白血病。
抗体介导的调节主要组织相容性复合体(MHC)分子,或MHC I类分子可构成一种有效的免疫疗法。在发表于Nature Cancer杂志上,题为“A single-domain bispecific antibody targeting CD1d and the NKT T-cell receptor induces a potent antitumor response”的文章中,研究人员描述了靶向人类MHC类I类分子CD1d的单域抗体如何调节CD1d限制T细胞的功能,以及同时特异性诱导I型自然杀伤T(INKT)细胞的激活。

DOI:https://doi.org/10.1038/s43018-020-00111-6
VHH1D12激活INKT细胞
为了获得目标纳米抗体,研究者首先对羊驼(llama)进行免疫,并通过构建噬菌体展示文库,最终筛选出CD1d特异性VHH。对这些VHH功能评估,又进一步鉴定出VHH1D5、VHH1D12、VHH1D22,其中,VHH1D12通过增强其对(弱)激动性抗原的反应性而选择性地激活了INKT细胞。VHH1D22特异性阻断I型NKT细胞反应性,而VHH1D5阻断多种NKT细胞,但I型NKT细胞对CD1d的识别不受影响,说明这些VHHs具有不同的CD1d结合模式。

CD1d VHH1D12单域抗体激活INKT细胞(来源:Nature Cancer)
VHH1D12的抗肿瘤活性
既往研究表明,INKT细胞被装载在CD1d上的原型糖脂抗原(α-GalCer)激活后,可释放Th1和Th2型细胞因子,并通过多种细胞毒性因子直接发挥抗肿瘤作用。在这篇研究中,作者观察到VHH1D12与表达CD1d的肿瘤细胞共培养会触发INKT细胞分泌包括干扰素-γ(IFN-γ),肿瘤坏死因子(TNF),白介素(IL)-4和IL- 2等的细胞因子,并且对表达CD1d的肿瘤细胞的细胞毒性与α-GalCer诱导的相似或更高。
在对来自多发性骨髓瘤(MM)和INKT细胞患者的新鲜骨髓样本的共培养中,VHH1D12诱导Th1型细胞因子(IFN-γ,TNF,IL-2)的大量产生,并对直接源自患者的肿瘤细胞具有明显的细胞毒性,这与细胞上CD1d的表达相关,且在统计学上比在α-GalCer中观察到的更为显著。同样,在来自急性髓系白血病(AML)和INKT细胞患者的骨髓样本体外共培养中,VHH1D12诱导了INKT细胞脱粒和对与CD1d表达相关的患者肿瘤细胞的细胞毒性。
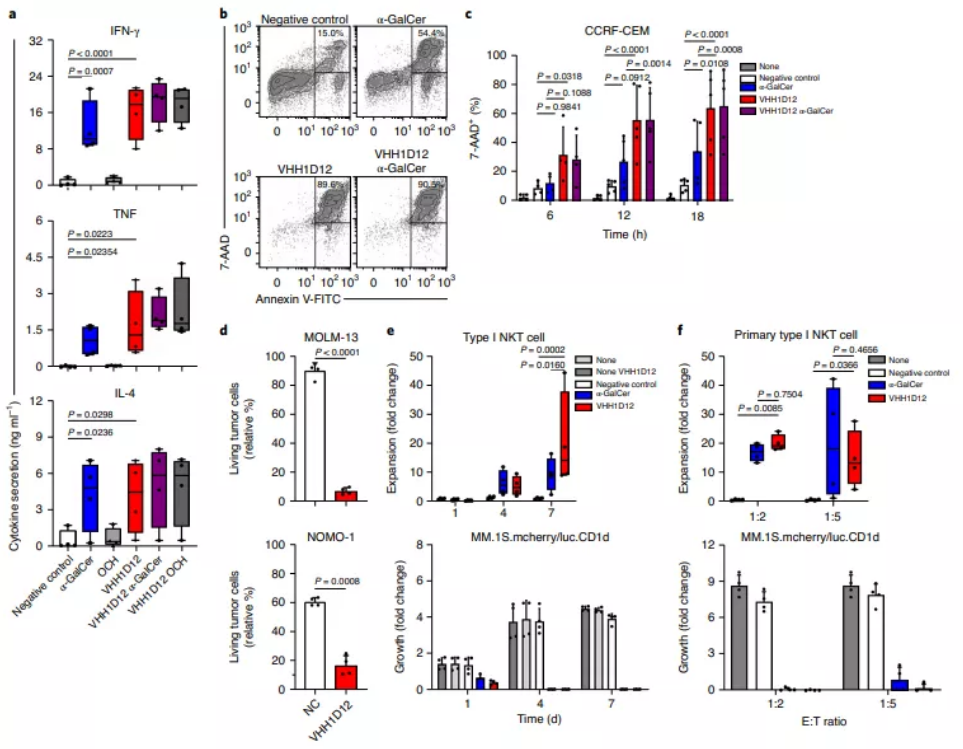
VHH1D12在体外触发INKT细胞增殖,细胞因子产生以及裂解表达CD1d的肿瘤细胞(来源:Nature Cancer)接下来,研究者进一步构建了免疫缺陷小鼠模型,以验证VHH1D12在体内的抗肿瘤作用。与单纯使用INKT细胞治疗的小鼠相比,当肿瘤植入后6周(研究终止时),研究者在用(人)INKT细胞加VHH1D12治疗的小鼠中观察到外周血CCRF-CEM细胞计数显著降低,另外,每两周一次腹膜内给予VHH1D12显著减轻了接受INKT细胞小鼠的肿瘤负荷,其中八分之三的小鼠在生物发光成像中均未检测到肿瘤负荷。这一数据表明,VHH1D12大大增强了INKT细胞介导的抗肿瘤能力,从而提高了小鼠的生存率。
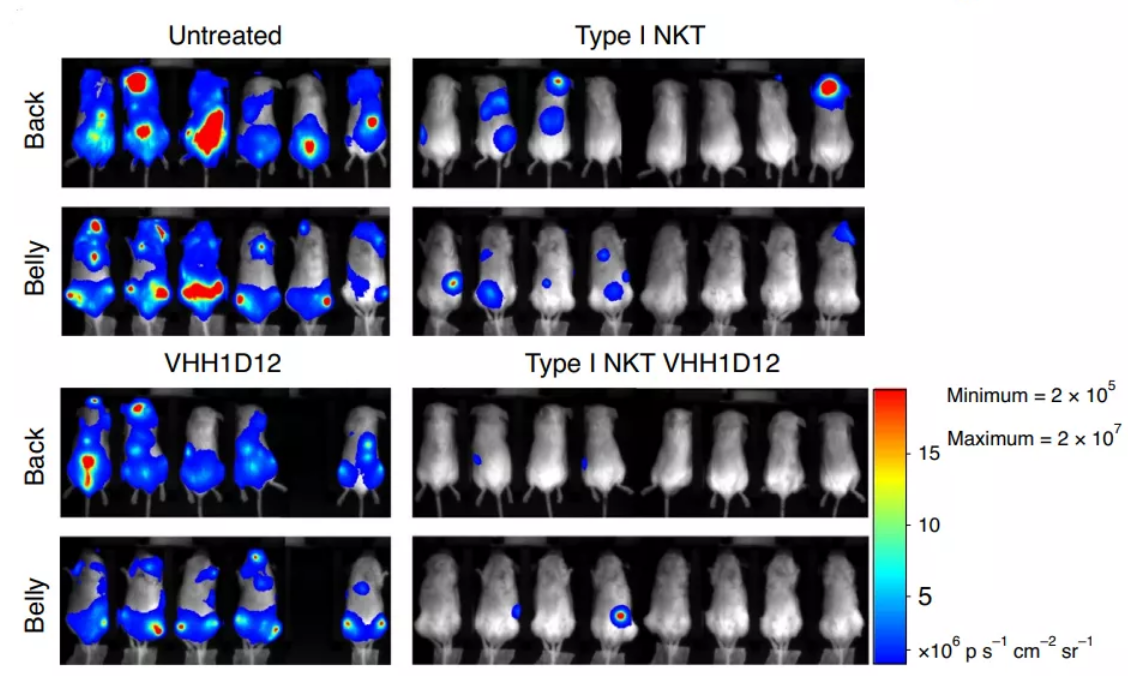
VHH1D12治疗前后小鼠成像图像对比(来源:Nature Cancer)总的来说,这项研究强调了一种新的纳米抗体片段VHH1D12在靶向复合表位方面的多功能性,这种由一个复杂的单态性抗原呈递分子和一个不变的TCR组成的结构,能够同时作用于CD1d和INKT
TCR,进而使得INKT细胞介导的体内外抗肿瘤活性大大增强。这一发现预示着一种未来可推广的抗肿瘤方法。
参考资料:
1. A single-domain bispecific antibody targeting CD1d and the NKT T-cell receptor induces a potent antitumor response







