纳米抗体介导PROTACs蛋白靶向降解技术
想要了解一个基因的功能,通常的做法是在DNA或mRNA水平抑制基因的表达,然后观察表型的变化,而表型的变化通常是由蛋白的缺失导致的。但是,这些方法没有直接作用于蛋白,只是暂停了蛋白质的转录或翻译,蛋白的缺失还是依赖于其自身的半衰期。因此,这些方法不能有效敲减半衰期长的蛋白或溶解度低的蛋白聚集体。在DNA或mRNA水平抑制蛋白的表达,通常需要较长的时间(>48 h),不能用于研究蛋白水平快速变化的生命过程,如细胞周期。正是因为时间的延迟,细胞有足够的时间启动其他补偿机制,弥补单个蛋白水平的下降,有可能掩盖了表型的变化。
为了可以直接降解目标蛋白,人们已经开发出了许多方法。Proteolysis targeting chimeras (PROTACs) 就是其中之一,它利用细胞本身的泛素-蛋白酶体系统来降解胞内蛋白。这项技术的局限之处在于,我们需要为目标蛋白找到高亲和力的小分子配体,这对于一些“不可被靶向”的蛋白来说往往是非常困难的。其他技术包括auxin inducible degron system【1, 2】、Trim-Away【3】和改造的纳米抗体【4, 5】等,这些方法需要对细胞内源蛋白进行改造,或需要特定外源蛋白的表达,各有优劣。
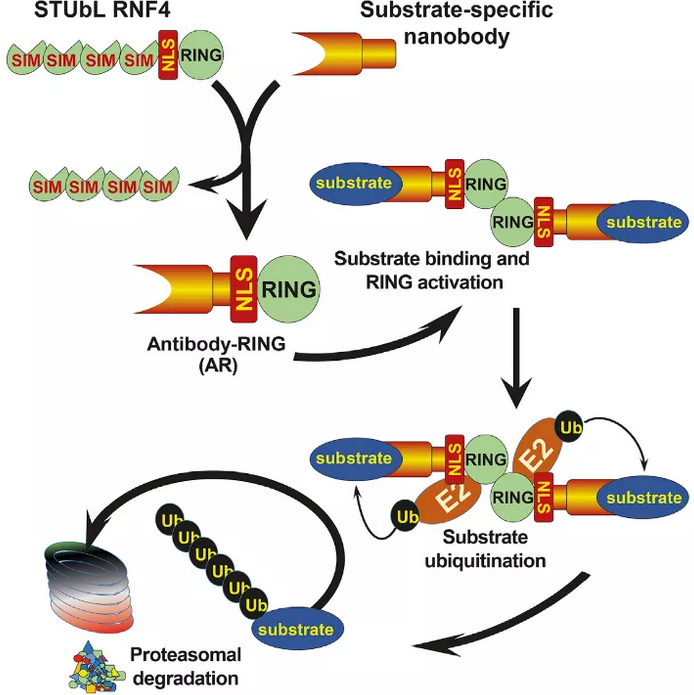
近日,University of Dundee的Ronald Hay课题组在Molecular Cell 上发表了题为Antibody RING-Mediated Destruction of Endogenous Proteins 的论文,报道了他们开发的Antibody RING-mediated destruction (ARMeD) 系统。研究者把E3泛素连接酶和骆驼纳米抗体组装在一起,引入细胞后可在数分钟内介导内源靶蛋白的降解,且没有检测到脱靶效应的存在。

E3泛素连接酶RNF4的C端为RING(Really Interesting New Gene)结构域,负责招募装载了泛素的E2。实验者把RING和特异性识别黄色荧光蛋白(YFP)的纳米抗体融合,成功在HeLa细胞引发了YFP-PARG(poly ADP ribose glycohydrolase) 融合蛋白的泛素化和依赖蛋白酶体的降解,初步证明了ARMeD系统的可行性。
接下来,作者要把ARMeD系统真正应用于细胞内源蛋白的降解。实验人员选定了一个靶点:NEDP1蛋白,并生产了一系列靶向NEDP1的骆驼纳米抗体。类似地,纳米抗体-RING融合蛋白成功促进了NEDP1的降解。更重要的是,研究人员通过蛋白质组学的方法,检测不到脱靶效应的存在,说明纳米抗体的专一性保证了ARMeD系统的高度特异性。
基因敲除或RNA干扰的方法并不适用于研究半衰期长的蛋白,如核孔复合体和神经退行性疾病相关的蛋白聚集体。这项研究中提出的单一组分ARMeD技术有效解决了这个难题。可以预见的是,随着越来越多的纳米抗体被开发出来,以及胞内递送技术的不断优化,ARMeD技术在基础研究和临床应用方面的优越性将逐渐显现。
参考文献:
1.
Holland, A.J., Fachinetti, D., Han, J.S., and Cleveland, D.W. (2012).
Inducible, reversible system for the rapid and complete degradation of
proteins in mammalian cells. Proc. Natl. Acad. Sci. USA 109, E3350–E3357.
2. Nishimura, K., Fukagawa, T., Takisawa, H., Kakimoto, T., and Kanemaki, M. (2009). An auxin-based degron system for the rapid depletion of proteins in nonplant cells. Nat. Methods 6, 917–922.
3. Clift, D., McEwan, W.A., Labzin, L.I., Konieczny, V., Mogessie, B., James, L.C., and Schuh, M. (2017). A Method for the Acute and Rapid Degradation of Endogenous Proteins. Cell 171, 1692–1706.e18.
4. Caussinus, E., Kanca, O., and Affolter, M. (2011). Fluorescent fusion protein knockout mediated by anti-GFP nanobody. Nat. Struct. Mol. Biol. 19, 117–121.
5. Fulcher, L.J., Macartney, T., Bozatzi, P., Hornberger, A., Rojas-Fernandez, A., and Sapkota, G.P. (2016). An affinity-directed protein missile system for targeted proteolysis. Open Biol. 6, 160255.
本文来自BioArtReports,原文链接:https://doi.org/10.1016/j.molcel.2020.04.032

