GMP级慢病毒载体制备CAR-T细胞之进展及未来 (二)
T细胞加工和CAR-T细胞生产
分离富集T细胞
Ficoll密度梯度离心法是去除红细胞和血小板的常用方法。此外,一些自动细胞收集器如COBE 2991 Cell Processor (Terumo BCT,Lakewood, CO), Haemonetics CellSaver (Haemonetics Corp., Braintree, MA), Baxter Cytomate (BaxterOncology, Chicago, IL), Biosafe Sepax II (GE Healthcare Life Sciences, Marlborough, MA),和 CaridianBCT Elutra (CaridianBCT, Lakewood, CO)用于T细胞的分离。为了去除特定的细胞群(如单核细胞,NK细胞群),经常使用磁珠分选系统。此前大量试验证实,大量的未知细胞阻碍T细胞的存活。Milteny开发了一种全自动的封闭系统CliniMACS系统(Miltenyi Biotec, Bergisch Gladbach,Germany),将各自独特的抗体偶联到磁珠上用来从异质性细胞群中分离纯化不同的细胞群。
分离完成后,细胞通常需要冷藏保存在血袋中,冷链运输到中央工厂后进行一些列富集,激活,转导步骤。为了减少冷冻和解冻带来的基因上的一些改变,已经提出了一些建议。T细胞分离是分离外周单核细胞关键的一步,以便起始培养细胞以高纯度的细胞培养开始,特别是在急性淋巴性白血病患者中存在高浓度的恶性循环B细胞。截止目前,在CAR-T生产中,已有anti-CD3+(T-细胞), anti-CD4+ (辅助T细胞), anti-CD8+ (效应T细胞), and anti-CD62L+ (中央记忆T细胞)的磁珠系统用于富集T细胞。
激活的T细胞
为了避免在体外T细胞激活步骤中使用抗原呈递细胞的繁琐过程,已经建立了几种方法:(1) 单克隆抗体和白介素刺激,如anti-CD3 和CD28mAbs, OKT3 (anti-CD3 antibody), IL-2, IL-7, 和IL-15,诱导产生了高比例的记忆细胞亚群。(2)细胞大小的磁珠微球,磁珠微球用CD3,CD28抗体包被,可强烈地诱导记忆和效应T细胞的增殖,细胞因子的分泌量提高了10-100倍,甚至比使用抗CD3抗体和IL-2刺激效果还好。(3)人工抗原递呈细胞如K562细胞,因为它可以激活T细胞,CAR-T细胞,主要是由于K562不表达HLA A和B,避免了刺激同种异体T细胞,而其表达内源性的共刺激分子(如CD40, CD40L, CD70, CD80, CD83,CD86, CD137L, ICOSL, GITRL, 和CD134L)可以方便地转导表达TAA(如CD19)
T细胞转导
LV转导是临床试验中第二大常用的基因传递方法。然而,一些基于质粒的基因传递系统,如转座子/转座酶系统(如SB和piggyBac)也有人提了出来。尽管利用SB系统来传递和整合目标基因的效率已经接近病毒转导的效率,不足之处仍然存在。例如,制备CAR-T需要的时间远远高于病毒系统。因此,最近一项基于病毒载体的CAR-T细胞的研究表明,通过将扩增时间从9-14天缩短至3-5天,可以大大缩短CAR-T细胞的产生时间。有趣的是,与后期(第9天)收获的CAR-T相比,早期(第3或5天)收获的CAR-T显示分化较低,体外抗白血病的活性增强。
SB基因整合系统可能会有效降低靶细胞插入突变产生的致瘤性。相比之下,PiggyBac系统有几个胜过SB系统的优点,包括高转到效率,转移大片段DNA的能力,可以插入高达几十万个碱基。
CAR-T扩增
在临床应用中,CAR-T细胞的扩增需要将培养物从培养皿/培养瓶转移到生物反应器中。已有许多生物反应器平台,例如GE WAVE生物反应器系统(GE Healthcare LifeSciences, Marlborough, MA), G-Rex 生物反应器(WilsonWolf, New Brighton, MN), CliniMACS系统等可便捷的进行CAR-T的扩增。如前所述,抗CD3和CD28微球被广泛用于实现CAR-T细胞的持续激活和扩增。然而,这些微球倾向于聚集和沉淀与系统底部,使细胞分离过程增加难度并延迟。这一问题导致了CAR-T细胞功能减弱和最终产物的损失。CD3/CD28的司具体抗体复合物(ExpamerTM, Juno Therapeutics, Seattle, WA)已经被开发了出来用于解决局上面微球的问题。CAT细胞扩增需要重点考虑的问题是如何保持CD4+和CD8+T细胞的平衡。而且,非转导的T细胞在有外源刺激因子刺激时也可以扩增。因此,基因工程化修饰的细胞(K562)被用做人工抗原递呈细胞来刺激CAR-T细胞特异性扩增。这些细胞都是符合GMP标准,基因工程化修饰表达一系列共刺激分子便于激活CAR-T细胞和扩增。
CAR-T细胞制剂
CAR-T细胞的配方仍然是一个很大的挑战,需要考虑很多关键因素,例如CAR-T细胞的维持条件,保存时间,在冻存和解冻过程中如何保持其活性和功能。低温储运是广泛应用的方法,在CAR-T配方中相对容易建立的操作。据研究报道,该方法不会损坏CAR-T细胞的分化,功能,和运动,而且低温保存10个月的CAR-T,再次解冻,细胞存活率仍保持在90%以上。最近,一项CAR-T低温保存的研究结果可以在实验室和大规模筛选中应用,其组分是生理盐水中包含8%的人血清白蛋白和15%的DMSO(DMSO终浓度为7.5%) 或CryoStor10 (BioLife Solutions, Bothell, WA) 培养基中含10%DMSO (DMSO终浓度 5%)。两种冻存液尽管有相似的存活率,但CryoStor10显示出更好的复苏效果,意味着该冻存液有着比生理盐水更好的储存效果。需要进一步的评估证实该发现。有关CAR-T细胞配方的研究有限,需要进一步的开展相关研究。

表1.GMP级别LV生产的主要参数
CAR-T在血液癌症和非血液癌症方面的临床试验
有关CAR-T用于临床试验最早的报道是10年以前,自那时起,CAR-T细胞已经成为针对淋巴瘤和白血病中cd19阳性肿瘤细胞的一种有效且成功的治疗方式,并且该领域正在向实体肿瘤扩展。截止2018年10月,已有400多项临床试验将CAR-T细胞疗法应用于各种癌症。大多数CAR-T临床试验在亚洲进行,特别是中国(~55%临床试验),这是目前CAR-T临床研究领域最活跃的区域。北美和欧洲的CAR-T临床试验分别为33%和10%。图7A展示了目前全球范围内CAR-T临床研究的区域分布。在血液学和非血液学恶性肿瘤中,CAR-T细胞治疗的新靶点的研究进展令人印象深刻。针对18种肿瘤表面抗原的CAR-T细胞治疗已进入临床试验。
此外,许多靶抗原,由于其在癌细胞中的特异性表达,正在进行临床前研究。除了CD19,还有其他几种抗原,如CD5、CD20、CD22、CD30、CD123、CD33、CD38、Ig k、ROR1、EpCam和BCMA已被考虑用于CAR-T细胞治疗以靶向血液恶性肿瘤。有趣的是,随着CAR-T细胞治疗的扩大,LVs在CAR-T细胞的产生过程中起着关键作用。因此,在2014年,大约54%的人使用了LVs CAR-T细胞治疗试验。图7B
CAR-T细胞治疗血液病恶性肿瘤的疗效已被证实,但在实体肿瘤中,可能由于肿瘤细胞的异种抗原表达和肿瘤微环境的免疫抑制作用,其治疗效果一直存在争议。因此,使用CAR-T细胞治疗实体肿瘤的临床试验数量低于血液系统恶性肿瘤(图7C)。这就促进了更多的尝试,鉴定新的靶点用于CAR-T靶向实体瘤。例如Her2,FAP, MSLN, GD2, CD70, MUC1, GPC3, IL13Ra2, PSCA,EGFR, VEGFR2, CEA, MET, PD-L1, PSMA, ROR1, EpCAM,和 EphA2, cancer/testis antigens, GUCY2C, TAG-72,和 HPRT1 已经被评估用于临床试验。在实体瘤中,CAR-T治疗常伴随一些致命的并发症,尤其是细胞因子综合征(CRS)和CAR-T相关的脑病综合征(CRES).因此,在转移性肾细胞癌患者的一期试验中,第一代CAR靶向CAIX的T细胞表达遇到了意外的肝毒性,这使得一些患者不得不停止治疗。所以,需要控制CAR-T细胞在体内的扩增和活性。
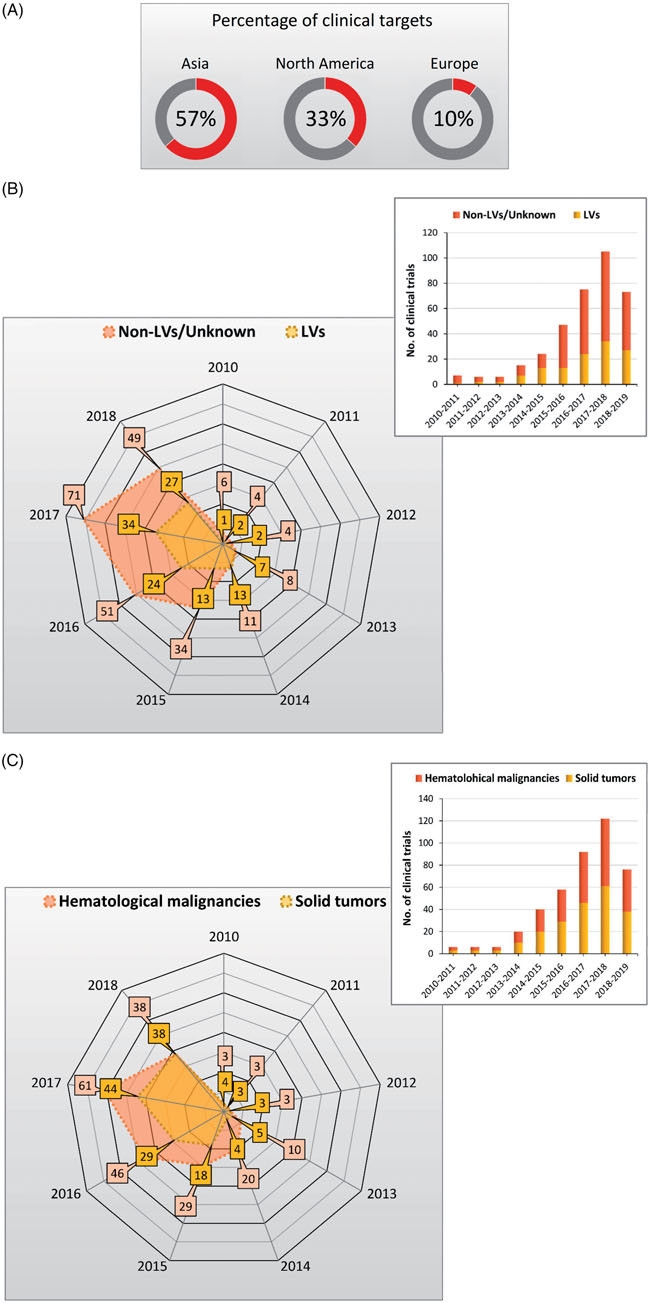
图7. CAR-T基因治疗临床试验
CAR-T临床治疗的挑战
副反应
细胞因子综合征
CAR-T细胞疗法可以引发一系列与传统疗法不同的副作用,迄今为止,CRS是最普遍的不良后果。CRS是由于免疫激活的开始导致炎症细胞因子水平升高,反过来就是治疗有效的信号。细胞因子水平明显提升的有IFN-γ,GMCSF, IL-1,IL-6和IL-10,已经在CAR-T治疗过程中报道过。虽然细胞因子是杀死肿瘤细胞所必需的,但它们也可能引起显著的副作用。因此,CAR-T细胞疗法是一把“双刃剑”,它会导致大量细胞因子进入血液,并可能危及生命。比较研究中出现的CRS严重程度和结果,一些CRS的分级标准被制定了出来,来统一评估CRS,CRS发作,CRS消退。此外,预测一些病理生理和分子生物标志物,如发热和MCP-1的结合可能有助于临床医生进行干预,并可能预防或减轻CRS和/或神经毒性;需要进一步的临床研究来证实这些预测生物标志物。
在少数情况下,CRS可以持续到2周后,病人可能需要转到ICU用于血流动力学稳定。实时监测血清细胞因子以识别CRS进程,面临着技术上的困难和高昂的成本。最近,肝细胞对IL-6产生反应的c反应蛋白被用作CRS发生和严重程度的临床标记。据报道,复发性/难治性B细胞患者的CRS发生率为19 ~ 43%。这种差异可能与该综合征的临床识别、嵌合受体设计和注入的细胞表型有关。
CAR-T细胞的毒性
多种CAR-T相关的毒性基本上包括“on-target on-tumor”, “on-target off-tumor” 和神经毒性。最常见的毒性是“on-target on-tumor” 主要由细胞因子释放过多或肿瘤细胞大量死亡引起的CRS和肿瘤裂解综合征。“On-target off-tumor” 指的是CAR-T细胞对正常组织的攻击,是最为显著的毒性。肿瘤免疫治疗最关键的问题是选择理想的靶点,该靶点明确的表达于所有肿瘤细胞,最好是为肿瘤细胞存活提供关键信号的分子。然而,由于大多数CAR-T识别靶点在正常组织中有表达,不同程度的“On-target off-tumor” 毒性是可预期的,从易控制的细胞系清除到严重的毒性,这些都是由于CAR-T细胞攻击正常组织造成的。CD19特异性CAR-T以B细胞白血病和B细胞淋巴瘤细胞表面CD19为靶点。这一抗原也在正常B细胞表面有表达,因此CD19 CAR-T“on-target off-tumor ”正常细胞,造成B细胞发育不全和低丙球蛋白血症使得患者易于感染甚至威胁生命。病人的免疫球蛋白G水平可以通过静脉注射免疫球蛋白来提高。同样的,其它一些“on-target off-tumor ”毒性,HER-2/neu特异性CAR-T细胞可引起呼吸衰竭、多器官功能障碍,并可对表达HER-2/neu的正常肺组织产生反应而死亡。
神经毒性,或CAR - T细胞相关脑病综合征,典型表现为神志不清、谵妄、表达性失语、一定程度的肌阵挛,偶尔伴有脑水肿和癫痫。这种不良结果,即CAR-T 治疗的另一个可能的副作用,在大多数情况下是可逆的。虽然神经副作用的确切病理生理学还不清楚,但人们认为神经毒性是细胞因子水平升高的结果。此外,一些研究表明,尽管在受影响的脑区缺乏CD19表达,但神经毒性与脑脊液中CAR-T细胞的存在存在一定的相关性。然而,所有神经毒性患者的脊髓液中均未检测到CAR-T细胞。神经毒性的病理生理学,以及它是来自于CAR-T细胞对中枢神经系统组织的直接攻击,还是来自于广泛的细胞因子介导的炎症,还没有得到研究。
缺少持久性
一些因素影响着CAR-T在体内的持久性:病人的前期治疗,起始CAR-T的质量和表型,培养条件和只被极少数,基因整合的方式,最终产品中CAR的分子设计,宿主对输注细胞免疫反应。此外,已证实非衰老的,非耗竭的T细胞有明显的抗肿瘤活性目前,研究正在进行关于解决CAR-T复制和寿命有限的问题,以增强T细胞在体内的持久性。例如,当修饰端粒酶的逆转录酶mRNA瞬时传递到CD19CAR-T中,研究表明,观察到这些细胞在B细胞恶性肿瘤小鼠移植瘤模型中的持久性和抗肿瘤作用得到改善。此外,其他研究表明,淋巴衰竭有利于增强体内CAR-T细胞的持久性。选择合适的T细胞表型另一个影响CAR-T细胞在体内持久性的关键因素。拥有中央T细胞表型(CD62L+)和/或记忆干细胞表型(CD45RA+)的CAR-T细胞表现出更强的体内扩增活性。另外,共刺激分子结构域如4-1BB, OX40(TNFRSF4), 和 ICOS 也可以影响CAR-T细胞持久性。
批间效应
在实体肿瘤中,肿瘤微环境是CAR - T细胞的严重屏障,在缺氧、营养缺乏、必需氨基酸缺乏、肿瘤微环境中代谢酸浓度高的情况下,CAR - T细胞可能无法增殖。此外,肿瘤组织中可能存在调节性T细胞、肿瘤相关巨噬细胞和肿瘤相关中性粒细胞等多种免疫抑制细胞。这些细胞产生多种免疫抑制因子和细胞因子,如TGF-β、PGE2、IL-10、IL4,以及活性氧,有利于肿瘤存活,抑制细胞毒性T淋巴细胞反应。为了克服这些瘤内免疫调节活动,Bollard 等人设计产生了表达TGF-β受体负调控结构域的CAR-T,以抵御内源性TGF-β产生的抗增殖和抗细胞毒性效应。最近,CAR-T细胞被改造成分泌scFv对抗免疫检查点,如PD-1。该策略成功阻断了PD-1与PD-L1的结合,提高了CAR-T细胞治疗在体内的整体抗肿瘤效果。为了改善CAR-T细胞向肿瘤的转运和浸润,提出了几种策略,包括使用特定趋化因子受体、整合素或选择素和免疫检查点抑制的T细胞转导。此外,局部注射CAR-T可以促进T细胞与癌细胞的相互作用。正在进行的临床试验将有助于评估CAR-T细胞定点给药的效率。虽然CAR-T细胞的区域传递可能弥补了t细胞转运的不足,但是局部注射CAR-T细胞比静脉注射更具挑战。同时,配合局部灌注,数量较多CAR-T细胞会聚集在肿瘤的特定位置,但是他们迁移到其他肿瘤区域的能力仍有争议。在另一项研究中,表达GD2-CART和CCL5的溶瘤腺病毒载体增加了CAR-T细胞的浸润,限制了神经母细胞瘤的进展。
展望
自体CAR - t细胞在肿瘤的免疫治疗中显示出了巨大的优势,为个性化治疗开辟了新的领域。多种策略已应用于GMP级CAR-T细胞的生产,以病毒为载体的方法占主导地位。在病毒载体中,LVs以其独特的优势广泛用于基因治疗,转导分裂和费分裂细胞,高度整合进宿主基因组,很好的的大片段整合效率,延长的转基因表达。因此,成功的工业生产级载体最重要的一步是产生足够数量的CAR-T细胞用于输注。然而,这些病毒载体有一些缺点,包括可能的插入突变,在包装构造中调控蛋白的存在(tat, rev) ,整合缺陷载体的瞬时表达,以及对pH变化和高盐浓度的敏感性,这限制了它们在临床研究中的应用。因此,基于非病毒载体的下一代自体CAR-T细胞(即SB和piggyBac转座子)也被引入临床应用。尽管几乎所有CAR-T细胞研究,目前使用的是自体t细胞,这些疗法存在一些局限性,包括成本、收获和制造过程中的不确定性、产品的可变性和QC、自体CAR-T细胞生产过程中的疾病进展、肿瘤细胞污染和T细胞功能障碍。因此,目前利用新技术设计和制造同种异体CAR-T细胞的研究应在该领域取得重大进展。现成的同种异体CAR-T细胞有可能为无法等待长时间生产过程的高危患者提供一种安全的CAR-T细胞替代来源。健康的供体异基因CAR-T细胞可以从hla匹配的造血干细胞移植供体中获得。此外,基因编辑方法(CRISPR/Cas9、ZFNs、TALENs、megaTAL核酸酶和工程I-CreI归巢内切酶)可用于生产非hla匹配患者的同种异体CAR-T细胞。然而,尽管基因编辑的同种异体有较好的抗肿瘤效果,但是一些CAR-T面临意想不到的风险,例如当切割发生在多个位点时,引起的基因的脱靶分裂和不必要的易位。尽管如此,“现成的”病毒特异性CAR-T细胞也可作为一类部分HLA匹配(1-4等位基因)的t细胞使用,这些t细胞在出现反应的患者中表现出最小的GVHD,尽管它们的效率很低。这些细胞也是制造同种异体CAR-T细胞的一个有吸引力的来源。近年来,诱导多能干细胞CAR-T细胞和TRAC CAR已经成为CAR-T细胞的来源。然而,这些异体CAR-T细胞的安全性和有效性尚不清楚。值得注意的是,制造同种异体CAR-Tcells的不同方法可能会在不同的给药时间点出现GVHD和/或排斥注入细胞,因此需要相对较长的重症监护随访期。淋巴耗损性化疗和免疫抑制的宿主细胞如调节性T细胞的减少,可能阻止GVHD和同种异体CAR-T细胞的排斥反应。此外,由于相关数据的可用性有限,要定义异基因CAR-T细胞的有效剂量并不像自体细胞那么容易。从不同供体获得的这些产品的个体差异也应被视为异体CAR-T细胞的缺陷。
本文转载自“生物制药小编”。
原文来源:
Poorebrahim M, Sadeghi S, Fakhr E,et,al. Production of CAR T-cells by GMP-grade lentiviral vectors: latest advances and future prospects.Crit Rev Clin Lab Sci. 2019 Sep;56(6):393-419.

