复制型CART病毒安全风险评估及控制
1. 概述
上篇文章《CAR-T系列之慢病毒包装质粒生产纯化及质量控制》着重介绍了慢病毒载体包装质粒的构建、生产纯化及质控。CAR-T的生产中常用慢病毒载体将CAR基因高效地导入T细胞中。尽管慢病毒载体具有复制缺陷,但如果在慢病毒生产过程中发生穿梭质粒、包装质粒和T细胞之间或慢病毒载体与T细胞的内源性逆转录元件之间发生同源或非同源重组,则可能导致复制型逆转录病毒(RCR)或复制型慢病毒(RCL)的潜在风险。Donahue对10只患有严重免疫缺陷恒河猴注射γ-逆转录病毒载体转导的骨髓系祖细胞,有3只动物患上了淋巴瘤,并在200天内死亡;Purcell等人在淋巴瘤组织中检测到了RCR,并且在感染的动物中检测到RCR引起的γ-逆转录病毒血症。这一事件引发了公众广泛的讨论,并导致FDA要求对逆转录病毒载体产品进行RCR检测,且要求监测捐赠者及接受细胞产品治疗的患者是否存在RCR。
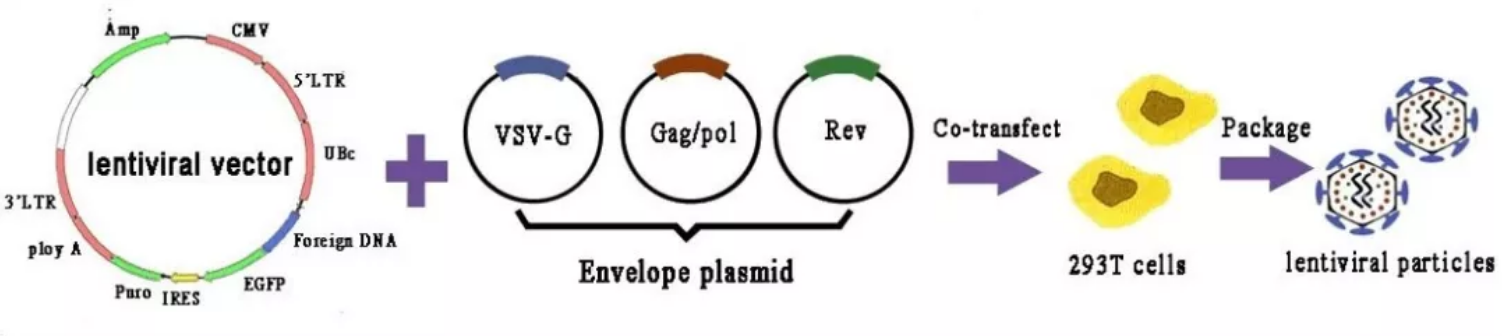
▲图1. 慢病毒包装过程
RCR/RCL的安全风险表现在两个方面:
A. 可将基因组整合在细胞基因组中,存在激活原癌基因、破坏抑癌基因造成二次肿瘤的风险,Howe等人报道了复制缺陷的逆转录病毒载体插入宿主基因组从而导致白血病的发生;Stein报道了因逆转录病毒载体插入导致癌基因EVI1过表达,最终造成基因组不稳定和骨髓异常增生。
B. 因其具有复制性,且用水泡性口炎病毒糖蛋白(VSV-G)替代了env编码的包膜糖蛋白,还大大提高了病毒的嗜性范围,增加RCR/RCL带来的潜在风险。
慢病毒来源于HIV-1,经过改造成为安全的慢病毒载体,其产生RCR/RCL的风险大大降低。
2. 慢病毒载体的安全性改进
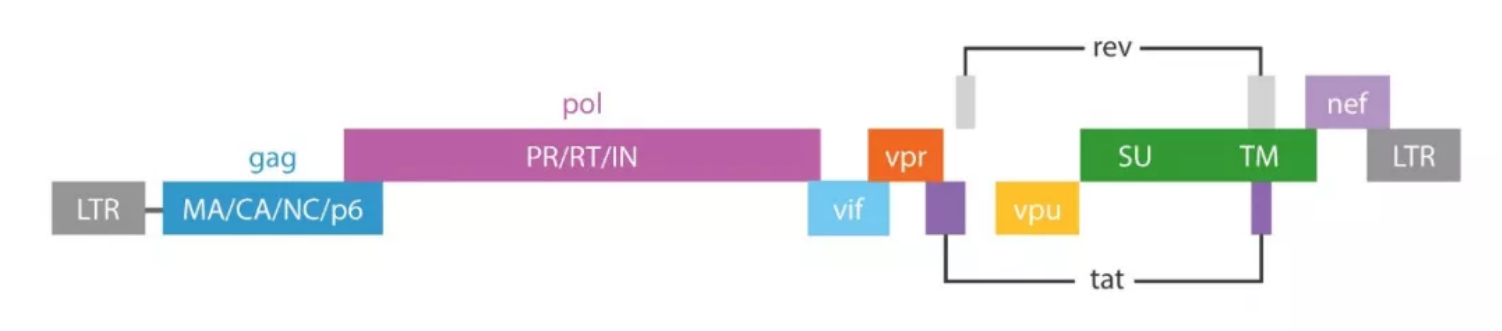
▲图2. 慢病毒包装过程
上图是HIV-1病毒结构及其基因组,其中gag基因编码p17、p24核心蛋白;pol基因编码蛋白酶、整合酶、逆转录酶等,为病毒增殖所必需;env基因编码表面抗原gp160,gp120和gp41。tat基因促进病毒基因转录和翻译。rev基因能增强gag和env基因的表达,以合成相应的病毒结构蛋白。vpu基因对HIV-1的复制、装配与成熟不可缺少。LTR包含了HIV-1的启动子和增强子区段,缺少了HIV-1无法完整复制。
慢病毒载体系统的建立,经历了一个逐步完善的过程。其主要的目的是提高载体的生物安全性,主要分为以下四个阶段:
2.1假型化
第1代慢病毒载体以Naldini以及Kafri构建的三质粒系统为代表,即载体质粒、包装质粒和包膜质粒。包装质粒的5′LTR用巨细胞病毒(Cytomegalovirus,CMV)早期启动子替换,3′LTR替换成SV40 polyA序列。包膜质粒则引入了VSV-G因表达包膜结构,进一步降低了慢病毒载体恢复成具有复制能力反转录病毒的可能,使感染宿主的范围几乎扩大到所有组织来源的细胞。VSV-G包膜赋予慢病毒载体颗粒高度的稳定性,使其能够通过超速离心而浓缩,提高滴度。另外,该系统包装信号被删除,包装序列不能整合至病毒基因组中,因此病毒感染宿主细胞后不能复制。但这个三质粒系统还是保留了HIV-1的附属基因,出现具有活性的病毒的可能较大,因而被认为安全系数较低。
2.2 敲除辅助基因
Zufferey等将包装质粒上的对目的基因的转移非必需且主要负责HIV-1病毒感染和致病性产生毒害作用相关的vif、vpr、vpu和nef基因敲除,从而得到第二代慢病毒载体。HIV-1原有的9个基因保留3个(gag、pol、rev)于构建的慢病毒载体中。
2.3 降低同源重组率
RCR及RCL是包装质粒、穿梭质粒及T细胞之间发生了同源重组产生的。为降低同源重组率,通过将gag-pol、Rev、VSV-G及CAR基因分别用不同的质粒携带,并且将质粒序列之间及人类基因组的同源性最小化,可以使RCR\RCL发生率显著降低。
2.4 自我灭活型转移载体
为了进一步降低产生RCR和RCL的概率,敲除了载体的5’和3’LTR区域对病毒复制和转录起重要作用的U3启动子和增强子元件,这种缺失的载体被称为自我灭活型载体,使慢病毒丧失了自我复制能力。
3. RCR和RCL检测方法及法规
3.1 RCR检测方法
1996年和1997年的FDA/NIH基因治疗会议上,基因治疗界对RCR进行广泛而深入的讨论,并公布了相关建议,这为当前FDA关于RCR检测提供了框架。虽然FDA还没有针对慢病毒载体的指导原则,但是现有的关于逆转录病毒载体和其他基因治疗产品的指导文件也适用于慢病毒载体。在逆转录病毒产品质控中,推荐使用基于细胞培养的方法进行RCR检测,该方法先经过体外扩增,然后通过高灵敏度的方法进行终点检测。
基于细胞培养的RCR检测最常用的是S+/L-法和标记物拯救法,这两种方法中,试验样品与一个敏感细胞系共培养至少3周(扩增阶段)。将可能存在的RCR进行扩增,再将扩增后的样本接种到检测指示细胞上,通过病变或特定产物表达鉴定是否RCR的存在。
在S+/L-法中,常用293(T)细胞进行RCR扩增,用被称为S+/L-细胞系的cat胶质细胞系PG-4进行检测,该细胞系含有小鼠肉瘤病毒基因组(S+),但缺乏小鼠白血病病毒基因组(L-)。在同时表达小鼠白血病和表达小鼠肉瘤病毒的细胞中,细胞可发生表型转化。将扩增阶段收集的细胞培养上清液与PG-4细胞共培养,细胞若发生表型转化则表明有RCR的存在。
标记拯救试验中,受纳细胞系包含一个带有易识别标记基因的逆转录病毒载体,样品经过三周的培养以放大任何潜在的RCR,收集细胞上清液,接种到初始培养的扩增细胞上,如果RCR存在,RCR的基因组和带标记基因的γ-逆转录病毒载体将会被RCR包装,感染细胞后,RCR将会使标记基因表达。
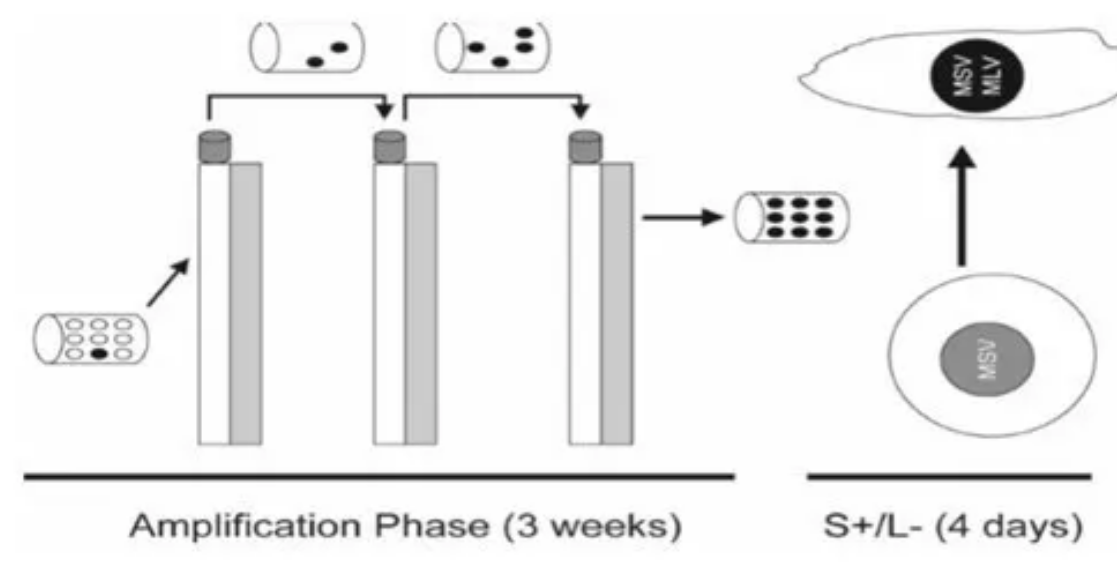
▲图3. S+/L-法流程
S+/L-法和标记物拯救试验中应设立合适的阳性及阴性对照以验证方法的灵敏度和专属性。
3.2 RCL检测方法
在慢病毒RCL检测方法中,使用对HIV-1的感染和生长都敏感的人T细胞系C8166作为受纳细胞。该方法是将样品与C8166细胞培养21天,以扩增任何潜在的RCL。用一个缺乏辅助蛋白编码基因的减毒HIV-1作为阳性对照。然后用扩增细胞上清液再感染C8166细胞,继续培养7天后,分析检测RCL病毒蛋白或核酸的存在。检测方法包括基于p24抗原的ELISA法,基于增强型逆转录酶活性检测法,基于包装质粒和穿梭质粒间的重组产生的psi-gag序列的PCR法,以及特异性检测VSV-G包膜基因的PCR法。
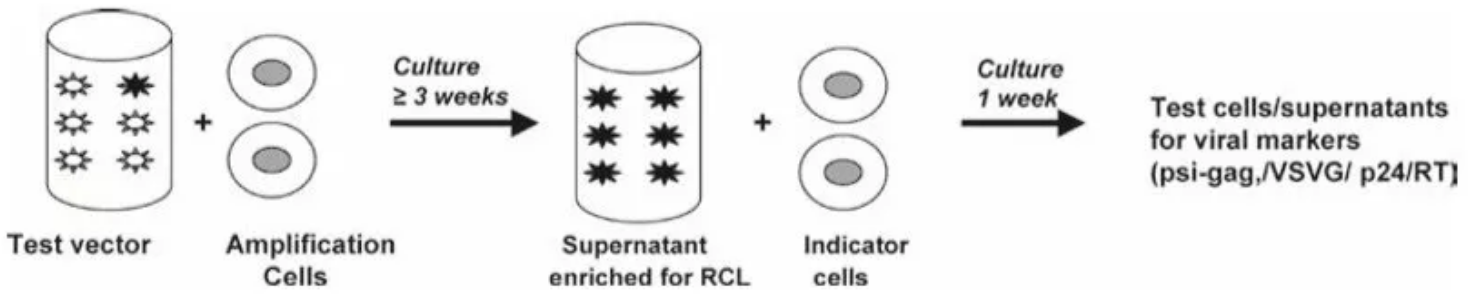
▲图4. RCL检测流程
3.3 RCR及RCL样品选择
慢病毒发酵收获液或纯化后的慢病毒均可用于RCR/RCL检测,若以慢病毒收获液为样本,可以直接地反映慢病毒在发酵过程中是否存在RCR/RCL,但要有效检出可能需要取较大的样本量。若以纯化后的慢病毒为样本,因慢病毒经纯化浓缩后,RCR/RCL同样也会得到浓缩,少许样本量即可达到有效检测,但纯化工艺可能会对原本含量很低的RCR/RCL造成破坏从而影响检测结果。不论选择何种样本,均需要对慢病毒RCR和RCL进行有效的工艺验证,以降低CAR-T产生RCR/RCL的风险。FDA建议在整个产品生产过程的多个阶段进行RCR及RCL检测,如下:
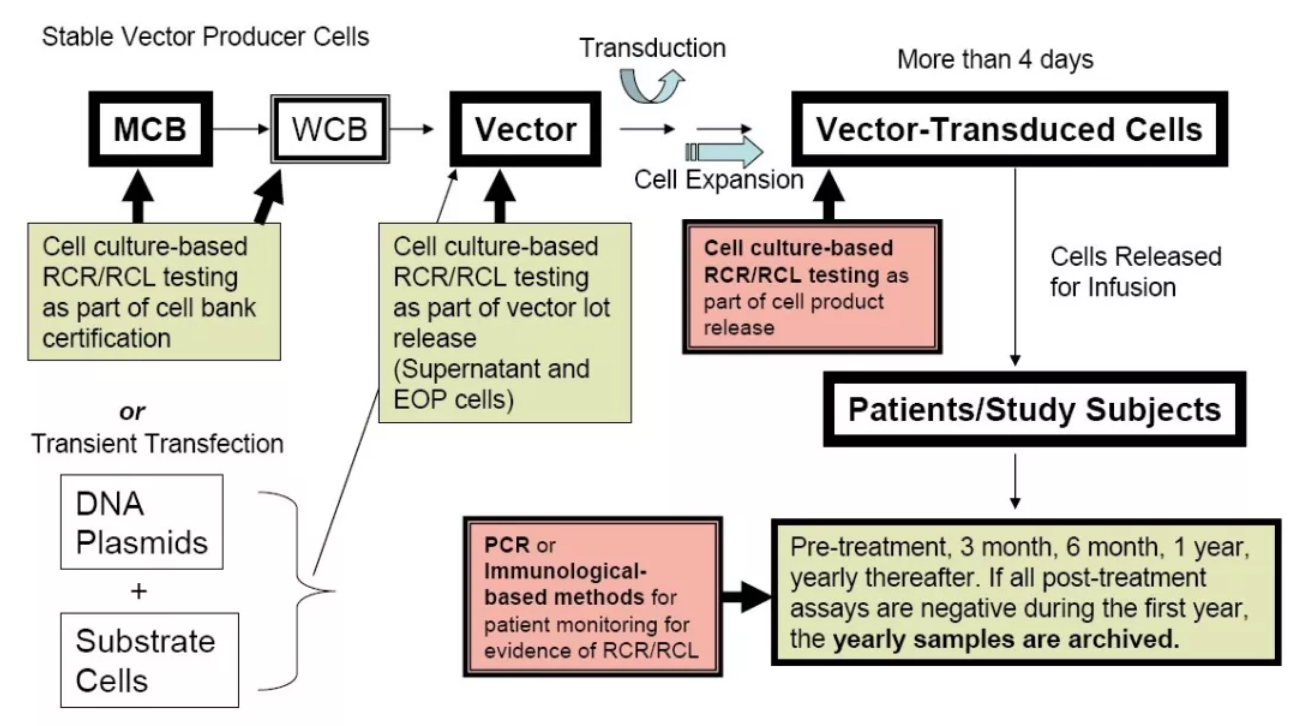
▲图5. RCR及RCL检测取样
RCR及RCL应在主细胞库(1次)、工作细胞库(1次)、发酵上清液(1次)、生产末期细胞(1次)和慢病毒载体转导细胞(如果转导后体外扩增超过4天)中进行检测。采用细胞共培养检测法,检测需设立阳性对照以证明检测的敏感性和特异性。此外,还需监测患者在接受治疗后是否存在RCR及RCL。
3.4 试验安全等级
RCR/RCL检测方法要求具有较高的灵敏度,建立及验证RCR/RCL检测方法时,可以考虑以RCR及RCL作为样本验证方法的最低检出水平。可以采用HIV-1弱毒株或重组的条件复制型慢病毒载体作为阳性对照。若以HIV-1弱毒株为阳性对照,其感染试验所涉及的培养应在P3级生物安全实验室条件下进行。但若采用条件复制型的慢病毒载体作为阳性对照,则可以在生物安全级别至少为P2的实验室开展实验。其他非HIV骨架的慢病毒载体,可以在P2生物安全实验室进行阳性对照病毒培养并开展方法学研究和样本检测。
小结
RCR/RCL是CAR-T细胞治疗产品一个安全性质量控制项目,因病毒载体设计的不同,产生RCR/RCL的风险也会有不同,如采用四质粒共转体系以及含有末端自我失活结构,慢病毒载体在生产过程中产生RCR/RCL的风险会明显降低,但尽管如此,产生RCR/RCL的风险仍不能完全排除,因此仍需要对慢病毒载体进行RCR/RCL的检测,且不得检出。
通常来讲,应对每批制备的慢病毒载体进行充分的RCR/RCL检测,包括高灵敏的PCR法及敏感细胞感染试验法。但结合现有慢病毒载体临床试验的安全性数据,具备P3实验室及复制型慢病毒载体制备较为困难,在CAR-T细胞产品临床试验早期,可考虑用灵敏的PCR法进行RCR/RCL的质控检测,但在确证性临床阶段以及上市前则必须采用敏感细胞感染试验监测慢病毒载体中的RCR/RCL的潜在风险。
下期我们将阐述慢病毒载体的生产、纯化及质量控制。
参考文献
1. Chong H, Starkey W, Vile R G. A Replication-Competent Retrovirus Arising from a Split-Function Packaging Cell Line Was Generated by Recombination Events between the Vector, One of the Packaging Constructs, andEndogenous Retroviral Sequences[J]. Journal of Virology, 1998, 70(5):2663-2670.
2. Garrett E, Miller R M, Goldman J M, et al. Characterization of Recombination Events Leading to the Production of anEcotropic Replication-Competent Retrovirus in a GP+envAM12-Derived ProducerCell Line[J]. Virology, 2000, 266(1):170-179.
3. Donahue R E. Helper virus induced T cell lymphoma innonhuman primates after retroviral mediated gene transfer[J]. J.exp.med, 1992,176(4):1125-1135.
4. Purcell D F, Broscius C M, Vanin E F, et al. An array ofmurine leukemia virus-related elements is transmitted and expressed in aprimate recipient of retroviral gene transfer[J]. Journal of Virology, 1996,70(2): 887-897.
5. Howe S J, Mansour M R, Schwarzwaelder K, et al. Insertional mutagenesis combined with acquired somatic mutations causesleukemogenesis following gene therapy of SCID-X1 patients[J]. Journal of Clinical Investigation, 2008, 118(9): 3143-3150.
6. Stein S, Ott M G, Schultze-Strasser S, et al. Genomic instability and myelodysplasia with monosomy 7 consequent to EVI1 activationafter gene therapy for chronic granulomatous disease[J]. Nature Medcine, 2010,16(2): 198-204.
7. 孙岩. HIV-1慢病毒载体的发展及其生物安全性[J]. 安徽农业科学(23): 7115-7116.
8. Sastry L, Cornetta K. Detection of replication competent retrovirus and lentivirus. [M]// Genetic Modification of Hematopoietic Stem Cells. Humana Press, 2009.
9. Escarpe, P. Development of a sensitive assay for detection ofreplication-competent recombinant lentivirus in large-scale HIV-based vectorpreparations[J]. Molecular Therapy, 2003, 8(2): 332-341.
10. 孟淑芳, 王佑春, 吴雪伶, 等. CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点[J]. 中国药事, 2018,32(06): 831-852.
11. Pauwels K, Gijsbers R, Toelen J, et al. State-of-the-art lentiviral vectors for research use: risk assessment and biosafety recommendations. Curr Gene Ther. 2009, 9(6): 459-74.
12. CAR-T系列之慢病毒包装质粒生产纯化及质量控制. 生物制药小编. 2019-08-27.
13. Wu X L, Meng S F, et al. Risk Analysis and Control of Replication Competent Virus in CAR-T Cell Therapy Products[J]. Chinese Pharmaceutical Affairs, 2018, 32(7): 879-885.
- 上一篇: CART病毒包装质粒生产纯化及质量控制
- 下一篇: 细胞疗法工艺之CART慢病毒生产详解

