【前沿】三特异性抗体,第三种抗癌免疫疗法?
只能特异性结合一个靶点的单克隆抗体是最早获得广泛临床应用的癌症免疫疗法(例如抗PD-1/PD-L1抗体)。随后,在此基础上改造的双特异性抗体作为癌症免疫疗法开始出现,这些抗体的一端可以与癌细胞表面的抗原结合,另一端与T细胞表面的T细胞受体结合,招募并激活T细胞杀伤癌细胞(如安进的Blinatumomab)。
而近期,赛诺菲(Sanofi)公司研发成员开发出一款三特异性抗体,不但能够与癌症相关抗原和激活T细胞的受体相结合,还能够与T细胞表面的另一个靶点相结合,以延长T细胞的抗癌活性。
相关研究以“Trispecific antibodies enhance the therapeutic efficacy of tumor-directed T cells through T cell receptor co-stimulation”为题发表在11月18日的《nature cancer》杂志。

图片来源:https://www.nature.com/articles/s43018-019-0004-z
对于这项最新研究,宾夕法尼亚大学佩雷尔曼医学院Carl
June博士等同日还专门在《Nature》发表题为“Trispecific antibodies offer a third way
forward for anticancer immunotherapy的”文章进行评议。

图片来源:https://www.nature.com/articles/d41586-019-03495-3
Blinatumomab是首个T细胞连接系统双特异性(CD19/CD3)抗体。作为免疫治疗的药物,Blinatumomab既能选择性地靶向结合患者过度增殖的B细胞淋巴母细胞表面的CD19蛋白,同时特异性地结合T细胞表面的CD3蛋白,从而激活T细胞,通过活化的T细胞来识别和杀灭过度增殖的B细胞淋巴细胞,它在治疗晚期B细胞急性淋巴细胞白血病(B-ALL)患者时,能够将患者的缓解率和生存期翻倍。
这类双特异性抗体的疗效是基于有效激活T细胞的抗癌活性。然而,通常T细胞被激活时,不但CD3受体介导的信号通路被激活,一种称为CD28的共刺激受体介导的信号通路也被激活。这种双重激活能够保证T细胞不但被激活,而且能够维持持久的活性。
为了同时激活CD28和CD3受体,赛诺菲的研究人员设计了一种三特异性抗体,它能够与多发性骨髓瘤(MM)细胞表面的CD38抗原,以及T细胞表面的CD3和CD28抗原结合。激活CD28受体能够刺激Bcl-xL蛋白的表达,Bcl-xL可以帮助阻断T细胞凋亡,从而延长T细胞的活性。CD28作为共刺激受体已经在CAR-T疗法中得到应用。某些CAR-T细胞表达的受体包含着CD3和CD28的共刺激蛋白域。而且,CD28经常在MM细胞表面表达,因此这一设计还可能提高三特异性抗体对MM细胞的亲和力。
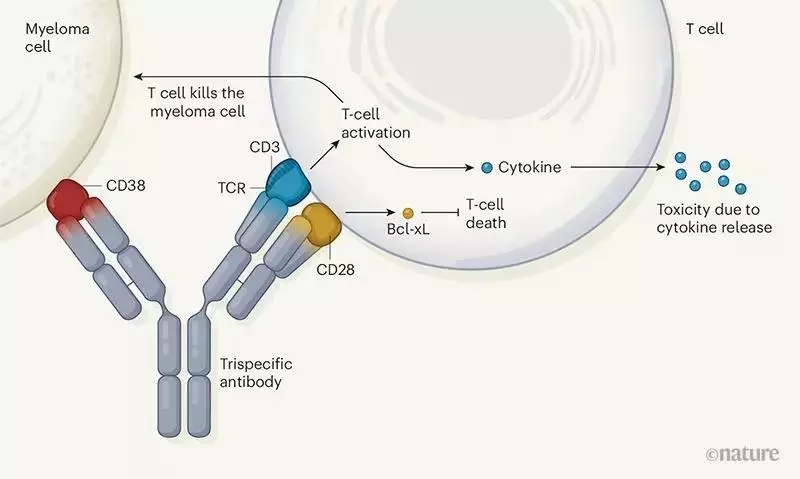
图片来源:https://www.nature.com/articles/d41586-019-03495-3
在体外试验中,与已经获得批准的CD38单克隆抗体daratumumab相比,三特异性抗体裂解的癌细胞比例提高了3-4倍。而且在小鼠的多发性骨髓瘤模型中,这款三特异性抗体也能够增强模型小鼠杀死不同骨髓瘤细胞系的能力。
![]()
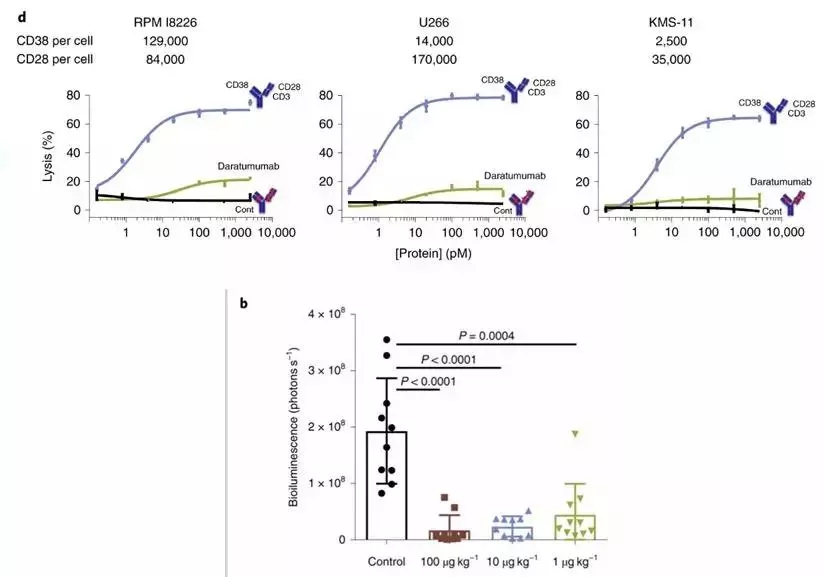
图片来源:https://www.nature.com/articles/s43018-019-0004-z
Carl June博士指出,这项研究的主要局限在于,细胞因子释放综合征(CRS)这种副作用的风险是未知的。在CRS中,许多T细胞的同时激活会导致免疫系统细胞因子信号分子的过度释放,从而引发炎症。在非人灵长类模型中,这款三特异性疗法表现出可控的安全性,不过它的安全性需要在人体和MM患者中得到验证。
Carl
June认为,使用三特异性抗体靶向癌症是一项重要的概念性进展。对于多发性骨髓瘤,需要新的治疗方法,因为即使是最有效的新兴疗法,包括靶向BCMA抗原的CAR-T,也仅对大多数人带来暂时缓解。三特异性抗体或能提供一种灵活的平台,根据肿瘤的微环境特异性递送免疫调节信号组合,从而比由三种单特异性抗体构成的组合疗法更为安全和有效。
我们期待,未来这种三特异性疗法还能扩大免疫疗法的范围,用于难以靶向的多种类型的癌症。

