Shocker!Nature报道引发CAR-T细胞治疗后复发的罪魁祸首居然是它...
Nature Medicine近期刊登了一篇有关单个CAR-B细胞诱导患者对CAR-T治疗耐受的文章:Inductionof resistance to chimeric antigen receptor T cell therapy by transduction of asingle leukemic B cell”,来自宾夕法尼亚大学的研究团队针对CAR-T治疗中出现的CAR转导白血病B细胞作了深入研究,旨在寻找接受CAR-T治疗患者出现复发及身体衰竭的主要原因,以下为爱康得生物原创翻译。
之前报告过一例接受CAR-T细胞(靶向CD19)治疗9个月后复发的B急淋病历,其CD19+白血病细胞异常表达CAR元件,在制备T细胞的过程中,CAR基因被稳定整合至单个白血病B细胞基因组中,并表达在B细胞膜上与B细胞表面的CD19结合后实现自我掩蔽,躲过了CAR-T细胞(CTL019)的识别并赋予B细胞自身抵抗能力。
抗CD19嵌合抗原受体(CAR)T细胞产品CTL019是第一个经FDA批准用于治疗儿童复发难治性急性B淋巴细胞白血病的基因修饰细胞疗法。尽管在B-ALL临床治疗中CTL019具有显著的疗效,但仍具有较高的复发率,复发患者常出现B细胞不表达CD19的情况。
一例20岁男性B-ALL患者(患者107#),在接受化疗及脐血移植复发后,参加了I期临床试验,以评估CTL019在儿童及年轻成人B-ALL患者中的安全性和有效性。预处理后,患者在2天内输注4.28×10^8个CTL019细胞。流式细胞仪检测显示CAR-T细胞在体内扩增的过程,一段时间后CAR-T细胞下降至外周血中无法通过流式细胞检出的状态;同时利用qPCR方法检测出CAR-T细胞在体内长期生存的过程(图1.a)。
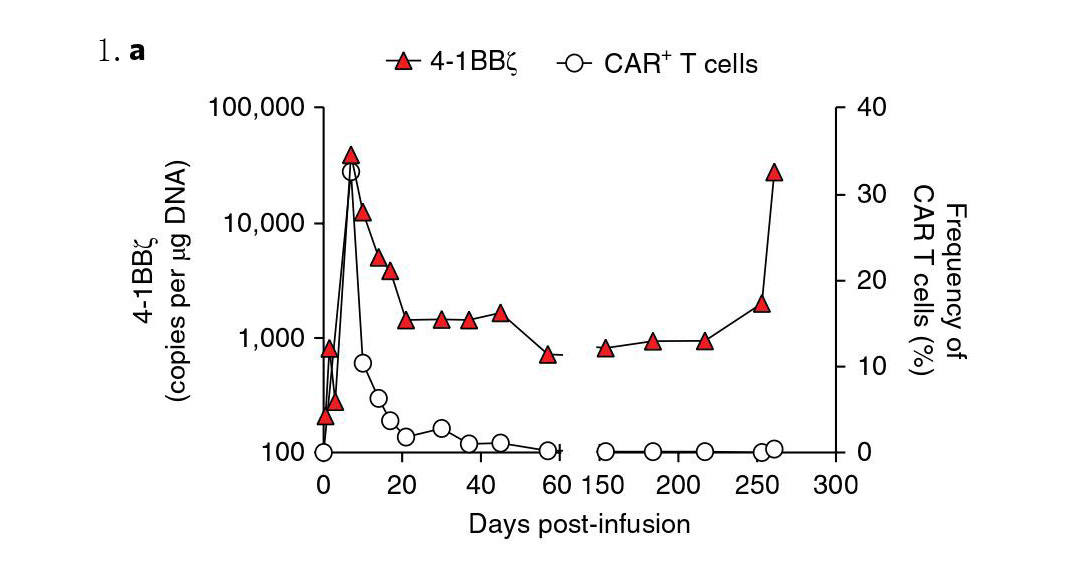
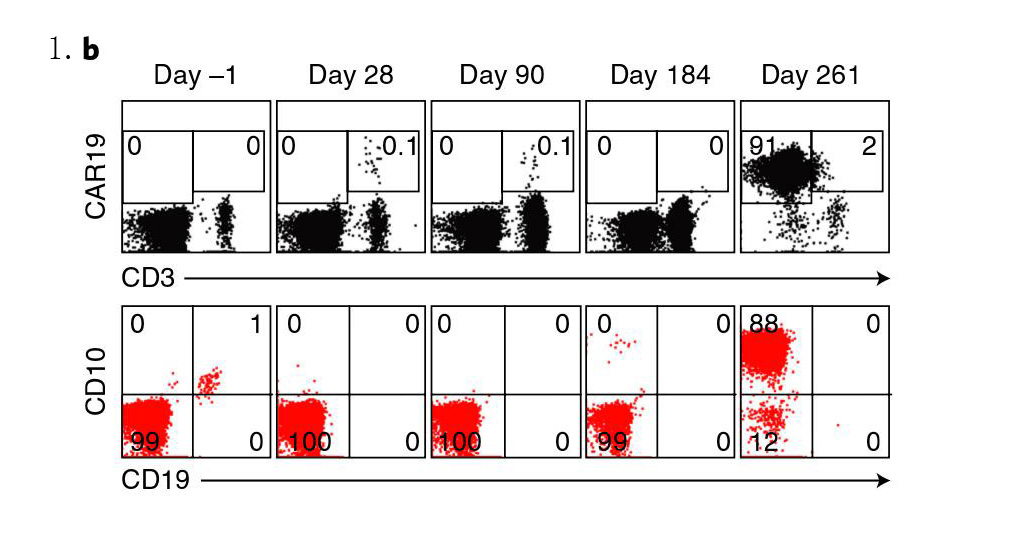
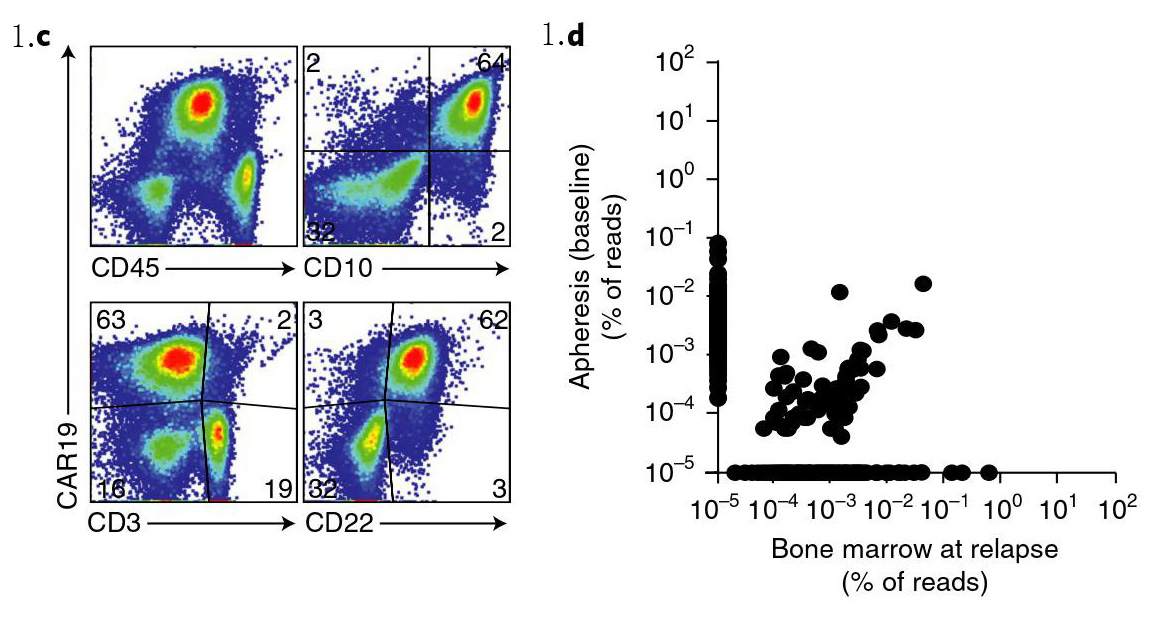
患者在CTL019输注后第28天完全缓解(图1.b)。然而,通过qPCR检测外周血中CAR特定序列时发现,第252天CAR特征性基因拷贝数(CAR阳性细胞)出现第二次的扩增。但流式细胞仪检测结果证明此次扩增并非CAR-T细胞(图1.a)。在第261天,患者出现了明显的复发症状(图1.b)。免疫表型分析结果进一步显示,这些表达CAR的细胞表型为CD3-CD10+CD22+CD45dim,它们实际上是表达了CAR的B淋巴细胞(CAR-B)(图1.c)。由于这是一种进展性疾病,我们尝试用长春新碱、泼尼松、巯基嘌呤和甲氨蝶呤进行补救治疗,并伴以九个疗程的莫西单抗(抗CD22抗体)及靶向CD22的CAR-T细胞免疫治疗。然而,患者的CAR-B细胞持续扩增,最终死于与进展性白血病相关的并发症。
为了追踪CAR-B细胞的来源,我们利用下一代免疫球蛋白重链测序(IgH-seq)分析了复发疾病的免疫球蛋白重链重排。这些细胞包含一个有效重排的等位基因和一个二级无效重排的等位基因。这些重排存在于CTL019输注前单采血液样本中,证实其与原发白血病的克隆相关。我们因此假设了CAR-B复发是由体内复制型慢病毒(RCL)转导产生或在CTL019制备过程中产生。在输注CTL019后的第3、6、9、12和20个月采集外周血样本中并未检测到任何RCL(图1.d)。随即利用IgH-seq对属于CTL019制品中的CAR-B细胞分析,鉴定了白血病克隆型,结果表明CAR-B细胞是CTL019细胞制备期间出现的副产品。
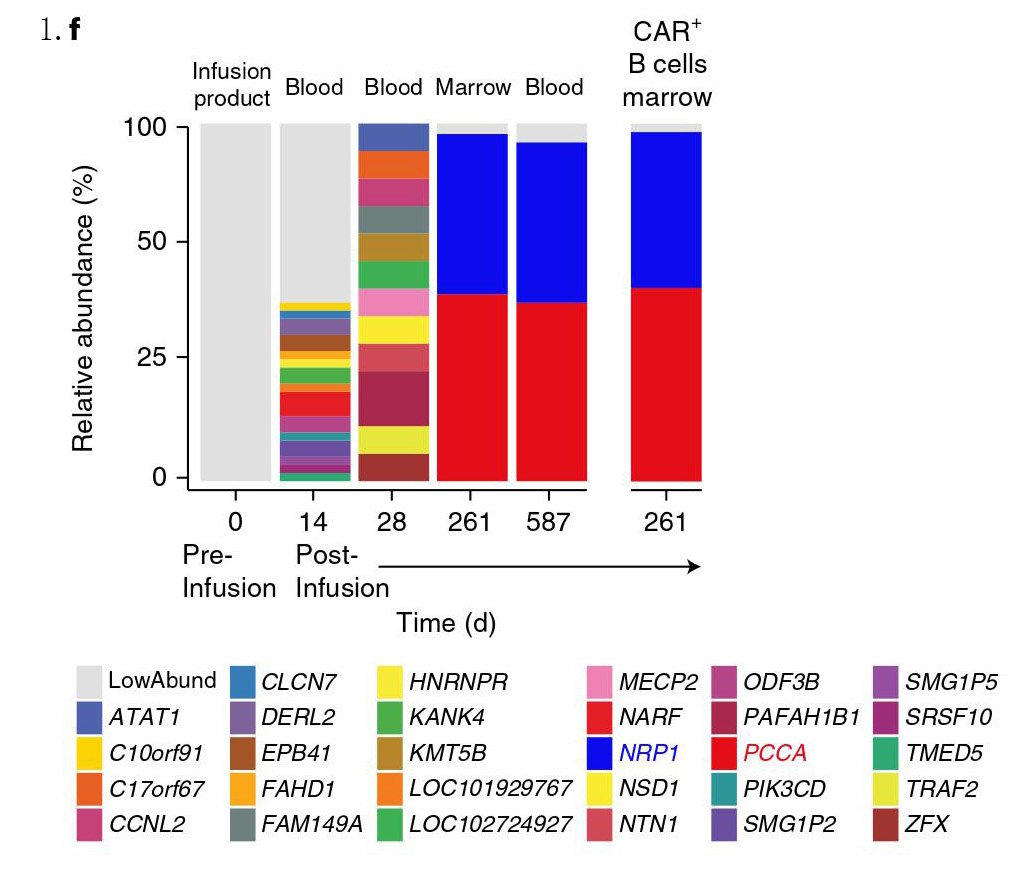
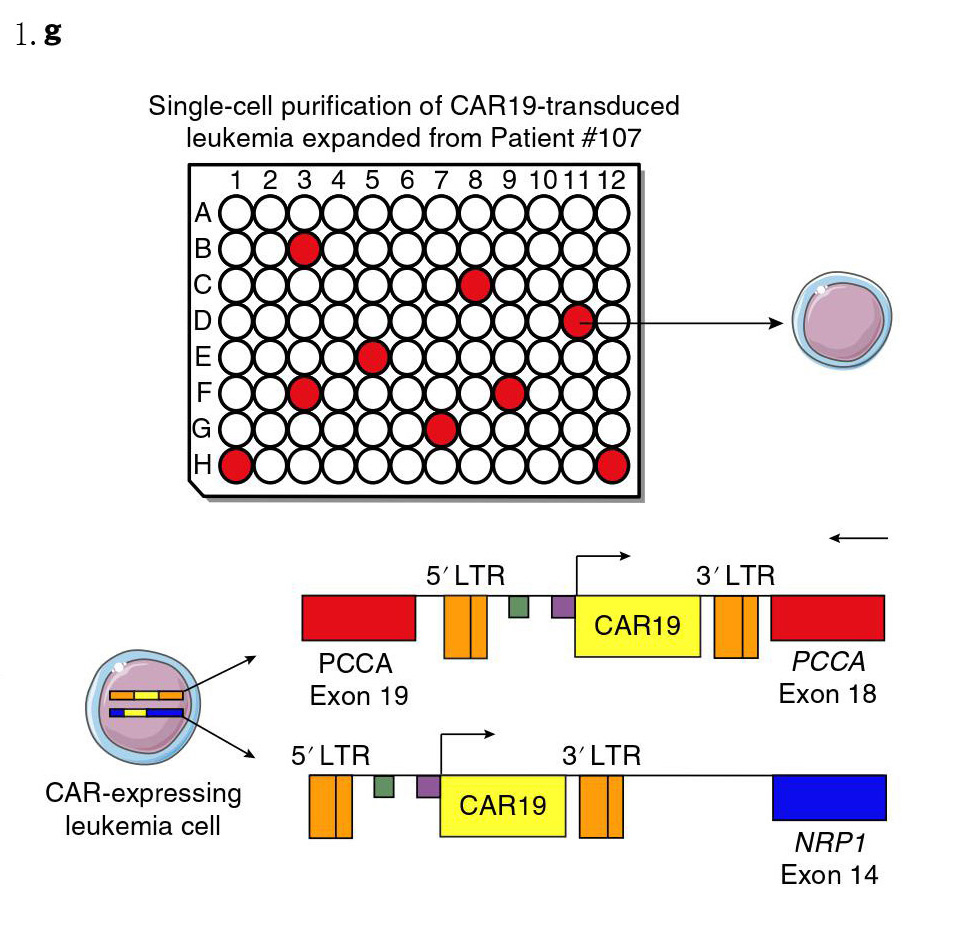
分析CTL019产品中慢病毒载体结合位点随着时间的动态变化(图1.f),在放行产品中出现了2924个插入位点,输注患者体内后,这些位点在1个月内降至12个。在输注后第9个月复发时,其中两个插入位点占抽样的97%,说明慢病毒转染的B细胞正在进行克隆性增殖;第一个位点位于13号染色体上PCCA基因的第18内含子,第二个位点位于11号染色体神经纤毛蛋白-1(NRP1)基因下游的62.5kbps处(图1.g)。这两个结合位点在CTL019产品中无法检测到(图1.f),可能是出现频率低于仪器检测阈值。虽然NRP1在B-ALL细胞中过度表达,但尚未有报道在急性淋巴细胞白血病中这两种基因异常。从患者体内分离白血病细胞分析PCCA和NRP1的表达水平,结果表明患者入组时采集的淋巴细胞和复发后采集的淋巴细胞中PCCA和NRP1表达水平相似。因此,该患者复发并非慢病毒介导的CAR基因插入导致的NRP1或PCCA突变所致。
为了证实该患者白血病复发源自单个B细胞克隆,在小鼠体内扩增患者第9个月复发时采集的细胞,并进行单细胞分选,对5个基因进行分析,包括PCCA和NRP1(图1.g)。在所分析的71个细胞中,通过靶向PCR分析发现9个细胞在所有5个检测载体-宿主结合的结果均为阳性,证实复发性B细胞在CAR-T制备过程中产生的单克隆细胞。
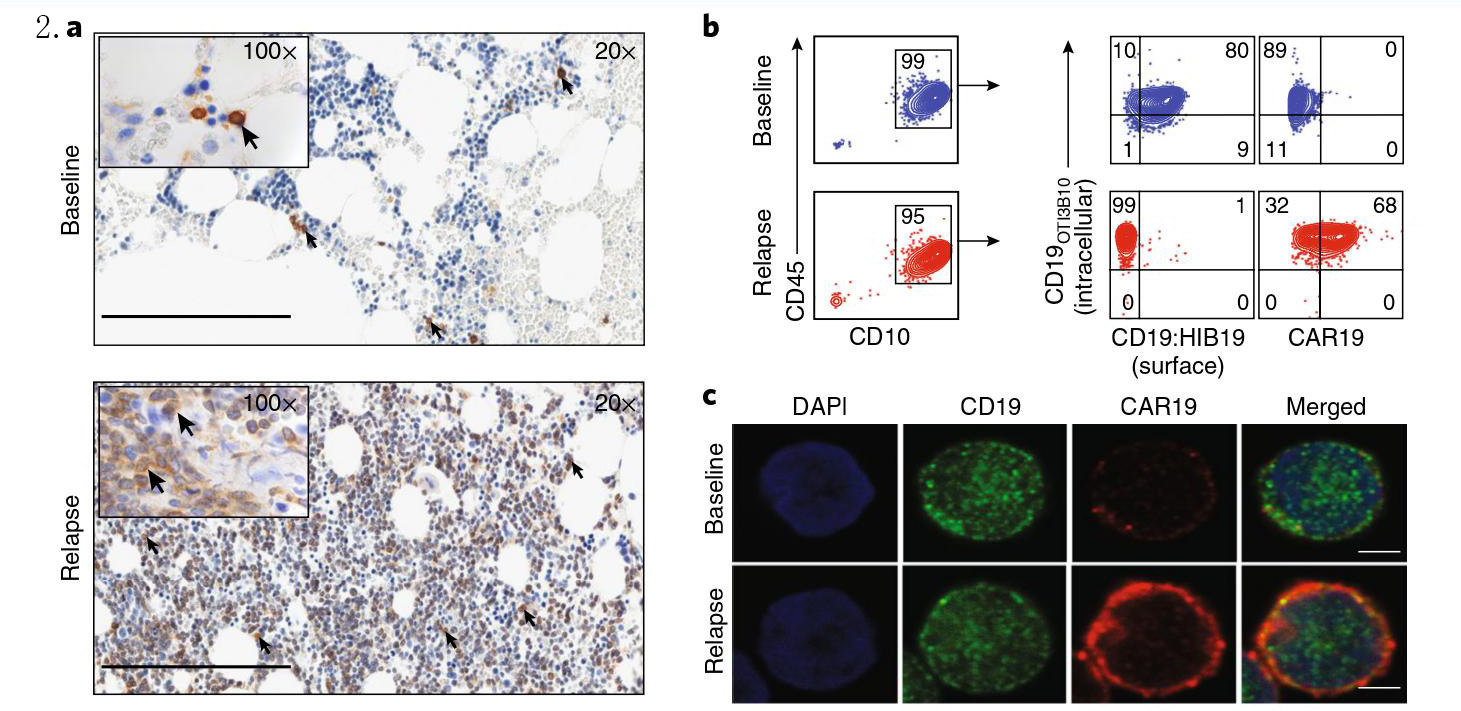
患者107#复发的CD19阴性的白血病细胞中伴有CAR的异常表达。因此,我们首先需要了解CD19未表达的原因。复发的白血病细胞CD19阴性可能是由于突变、mRNA的选择性剪接或B细胞受体复合蛋白CD81的突变导致。然而,在患者107#中并未发现以上异常。虽然通过流式细胞仪不能检测到CD19蛋白表达,但是在入组时单采的样本和复发后采集的样本中均可以检测到CD19的mRNA;而且,对复发后的骨髓样本进行免疫组织化学(IHC)染色分析发现CD19的蛋白表达(图2.a)。用于IHC的OIT3B10抗体识别CD19胞内结构域。因此推断流式细胞仪未检测到CD19是由于CAR与CD19的结合后掩盖了流式抗体识别的CD19胞外表位。竞争性结合实验结果显示,流式细胞仪检测到的所有CD19细胞外表位特异性单克隆抗体,包括HIB19,均被FMC63(CD19 CAR单链抗体scFv)阻断。随后我们通过流式细胞术证实单克隆抗体OTI3B10(或EPR5906:另一种识别CD19胞内表位的特异性单抗)可正确结合患者入组时以及复发后样本中的CD19蛋白胞内段,而HIB19只能够与入组时患者的肿瘤细胞结合(图2.b)。由此我们证明CD19蛋白实际上在复发的白血病细胞中有表达,但是它不能被识别胞外CD19表位的单克隆抗体结合,包括来源于CAR的单克隆抗体。为了评估CD19表达于细胞表面或仅表达于细胞内,我们使用共聚焦显微镜来检测CAR和CD19在复发性白血病细胞表面的共定位(图2.c)。
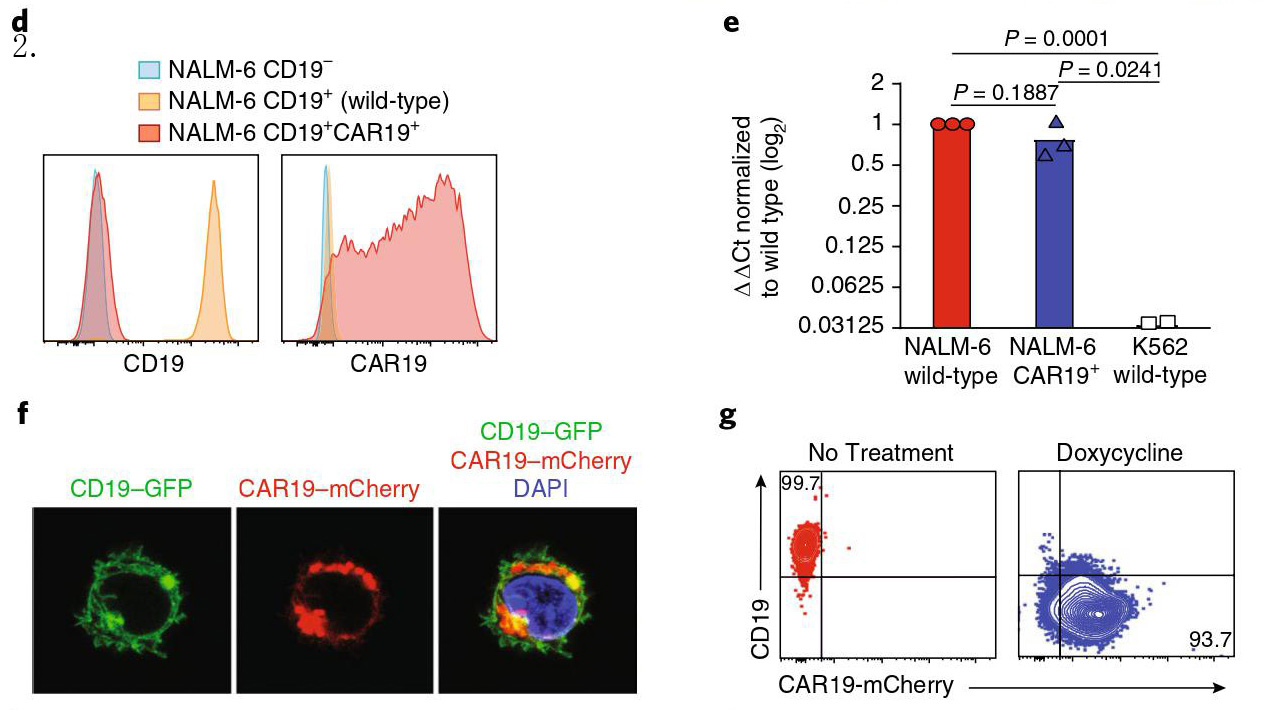
根据观察结果,CD19蛋白存在于白血病细胞表面,但不能被识别CD19胞外段的抗体检测到。因此,我们推测流式细胞术未检测到CD19是由于白血病细胞表面CAR与CD19结合,掩盖了流式细胞术检测的表位。我们成功地模拟了CAR转导的B-ALL细胞系(CD19+NALM-6)中的这种“表位掩蔽”现象,并利用标准流式细胞术检测出现CD19表达丢失的现象(图2.d)。但CD19转录本却保留了下来(图2.e),并且能够观察到CD19和CD19特异性CAR蛋白(图2.f),这与我们从患者107#复发的CAR+19+B白血病细胞中的观察相符。CAR表达直接介导CD19表达的“丢失”。当CAR在强力霉素条件下诱导表达时,检测CD19表达“丢失”(图2.g)。
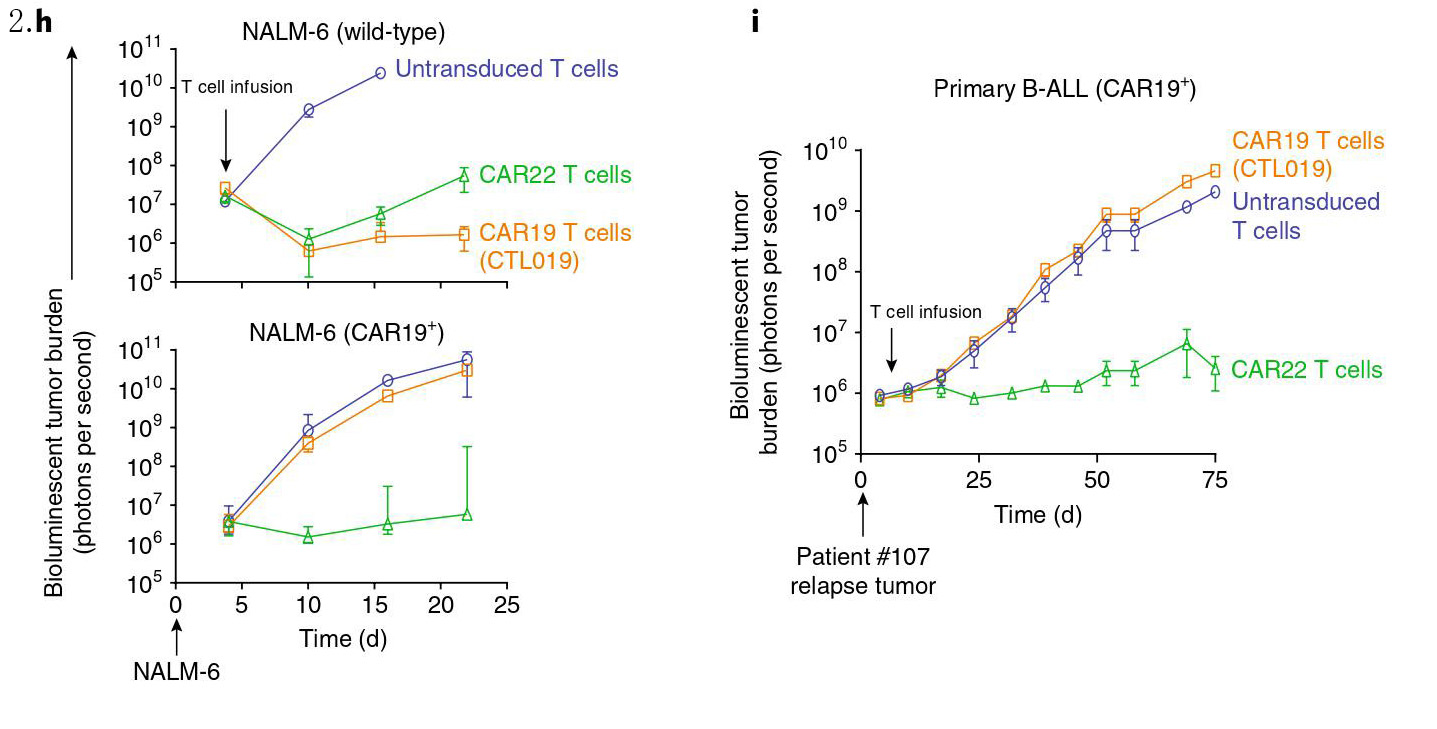
在小鼠移植瘤模型中,CAR+ NALM6白血病细胞对CTL019介导的杀伤有抵抗力,但对抗CD22 CAR-T细胞无抵抗力(图2.h)。将107#患者复发的(CAR-B)细胞接种到小鼠体内,使用健康供体制备的CTL019 T细胞或靶向CD22 CAR-T细胞治疗,结果发现只有靶向CD22的CART细胞能够诱导缓解,表明107#患者复发不是由于患者自体CAR-T细胞的功能受损,而是由于B细胞膜表达CAR导致的内在白血病耐药机制(图2.i)
为了了解“表位掩蔽”的复发机制是否也适用于其他CAR-T细胞靶点,我们测试了靶向CD22的CAR疗法。表达CD22的NALM-6细胞分别转染了两个不同的靶向CD22的CAR(HA22-或m971单克隆抗体识别膜远端表位和膜近端表位)。在这个模型中,只有当流式细胞术检测用抗体与CAR结构中的scFv识别相同的CD22表位时,才会出现CAR-NALM6细胞表面CD22表达“丢失”的现象;而且CAR22+NALM6(HA22-或m971 CAR)细胞仅对表达相同CAR22单链抗体的CAR-T细胞具有耐药性。这些结果表明表位掩蔽可以介导对CAR-T的抗性,此结果与CTL019产品中观察到的一致。
爱康得原创翻译,英文原文源自Nature Medicine。

